
| A. | H | B. | Na | C. | Al | D. | Si |
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠既是氧化剂又是还原剂 | |
| B. | 3摩尔过氧化钠发生反应,有12摩尔电子转移 | |
| C. | 在高铁酸钠中铁为+4价,具有强氧化性,能消毒杀菌 | |
| D. | 高铁酸钠既是氧化产物又是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
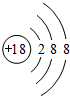
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| B. | sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 | |
| C. | C、H之间形成的是s-p σ键,C、C之间的π键是未参加杂化的2p轨道形成的 | |
| D. | C、C之间形成的是sp2-sp2σ键,C、H之间是未参加杂化的2p轨道形成的π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ag某气体的分子数为b,则cg该气体在标况下的体积为$\frac{22.4bc}{a{N}_{A}}$L | |
| B. | 2L0.5mol.L-1磷酸溶液中含有H+的数目为3NA | |
| C. | 25℃,PH=13的Ba(OH)2溶液中含有OH-为0.1NA | |
| D. | 标准状况下,28g乙烯和丙烯的混合气体中,含有碳碳双键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
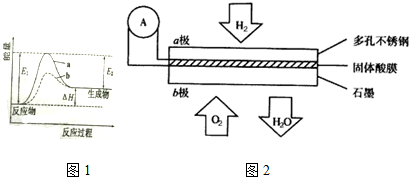
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 加料方式(mol) | H2的体积分数 | ||||
| 物质 | CO(g) | H2O(g) | CO2(g) | H2(g) | |
| 加料一 | 1 | 3 | 0 | 0 | a% |
| 加料二 | 0 | 1.2 | 0.6 | 0.6 | b% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com