
| 选项 | 操作 | 现象 | 结论 |
| A | 某溶液加入K3[Fe(CN)6]溶液 | 黑色沉淀生成 | 证明原溶液中存在Fe2+ |
| B | 某溶液加入HNO3、BaCl2混合液 | 产生白色沉淀 | 该溶液一定含有SO42- |
| C | 将水蒸气通过灼热的铁粉 | 粉末无变化 | 铁与水蒸汽高温下不反应 |
| D | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;
B.硝酸具有强氧化性,能氧化SO32-、HSO3-生成SO42-;
C.高温下,铁和水蒸气反应生成黑色的四氧化三铁;
D.钠和乙醇能反应生成氢气而产生气泡.
解答 解:A.亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,产生沉淀颜色错误,故A错误;
B.硝酸具有强氧化性,能氧化SO32-、HSO3-生成SO42-,从而干扰实验,应该用盐酸酸化,故B错误;
C.高温下,铁和水蒸气反应生成黑色的四氧化三铁,Fe和四氧化三铁都是黑色固体,通过观察无法判断是否反应,故C错误;
D.钠和乙醇能反应生成氢气而产生气泡,从而确定Na能置换出醇羟基中的氢,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、物质性质,明确实验原理、物质性质特殊性是解本题关键,侧重考查学生分析判断及知识综合运用能力,易错选项是B.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 2ml0.3mol/L的硅酸钠溶液中滴入稀盐酸所制得的硅酸胶体中胶粒的数目为0.0006NA | |
| B. | 常温下,1LpH=2的H2S溶液中H+的数目为0.01NA | |
| C. | 1mol铁粉与22.4L(标准状况)氯气充分反应,转移的电子数是3NA | |
| D. | 常温常压下,2.8gC4H8中有1.2NA的共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
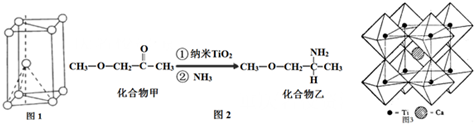
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
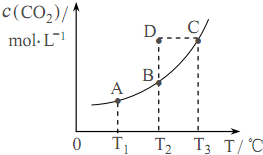 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T2时,若反应处于状态D,则一定有V正<V逆 | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H<0 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可以漂白纸浆和草帽辫 | |
| B. | 单质硅可用做半导体材料 | |
| C. | 小苏打可作食品的膨松剂 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
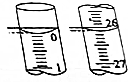 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
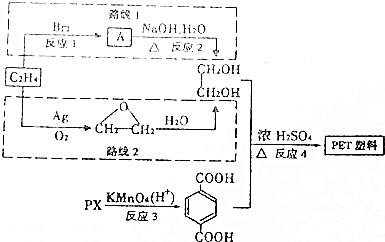

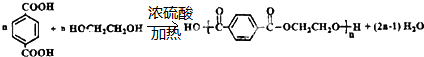 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下列分散系最不稳定的是
A.向NaOH溶液中通入CO2得到的无色溶液
B.向碘的水溶液中滴加四氯化碳充分振荡后,静置后的下层液体
C.向沸水中滴入饱和的FeCl3溶液得到的红褐色液体
D.向稀硫酸中加入BaCl2溶液得到的分散系
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:推断题
现有铁粉、铜粉和Cu(OH)2三种固体,以及CuSO4、KOH、KNO3、FeSO4、K2SO4和稀硫酸等6种溶液,它们中的某几种在常温下相互转化,关系如下:
①固体甲+溶液B=溶液C+水
②溶液A+溶液C=固体甲+溶液D
③固体乙+溶液B=溶液E+氢气
试回答下列问题。
(1)根据以上关系推断出(写化学式)
甲____ _乙 _ ___B____ _E_____
(2)写出上述反应的离子方程式
① ;
② ;
③ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com