
【题目】配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)光谱证实单质铝与强碱性溶液反应有![]() 生成,则
生成,则![]() 中存在__________(填序号)
中存在__________(填序号)
a.共价键 b.非极性键 c.配位键 d.![]() 键 e.π键
键 e.π键
(2)![]() 可形成两种钴的配合物,已知
可形成两种钴的配合物,已知![]() 的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加
的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加![]() 溶液时,产生白色沉淀,在第二种配合物的溶液中加
溶液时,产生白色沉淀,在第二种配合物的溶液中加![]() 溶液时,则无明显现象。则第一种配合物的结构可表示为____________________,第二种配合物的结构可表示为____________________。若在第二种配合物的溶液中滴加
溶液时,则无明显现象。则第一种配合物的结构可表示为____________________,第二种配合物的结构可表示为____________________。若在第二种配合物的溶液中滴加![]() 溶液,则产生的现象是____________________。(提示:
溶液,则产生的现象是____________________。(提示:![]() 这种配合物的结构可表示为
这种配合物的结构可表示为![]() 。)
。)
【答案】acd ![]()
![]() 生成淡黄色沉淀
生成淡黄色沉淀
【解析】
(1)[Al(OH)4]-的中心原子Al采用sp3杂化,形成4个sp3杂化轨道。Al最外层的3个电子分别与3个羟基形成σ键,还有一个空轨道接纳OH- 中O的孤对电子形成配位键;羟基中的O和H形成σ键;所有键均属于共价键中的极性键。所以,a.共价键、c.配位键、d.![]() 键正确。答案为:acd;
键正确。答案为:acd;
(2)Co(NH3)5BrSO4中共有7个分子或离子可做配体,而Co3+的配位数是6,则外界可能是Br-或SO42-。在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,证明其外界为SO42-,则其结构为[CoBr(NH3)5]SO4;第二种配合物的结构应为[Co(SO4)(NH3)5]Br,在溶液中电离出Br-,所以,溶液中加AgNO3溶液时,生成淡黄色的AgBr沉淀。
答案为:[CoBr(NH3)5]SO4;[Co(SO4)(NH3)5]Br;生成淡黄色的沉淀。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO的浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__。
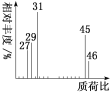
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为__,该物质的分子式是__。
(3)根据价键理论,预测A的可能结构并写出结构简式:__。
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如,甲基氯甲基醚(ClCH2OCH3,有2种氢原子)的核磁共振氢谱如图甲所示:
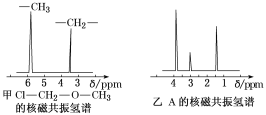
经测定,有机物A的核磁共振氢谱如图乙所示,则A的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废渣中含有Al 2O3和Cr2O3(三氧化二铬),再次回收利用工艺流程如下。

回答下列问题:
(1)滤液1中阴离子为CrO42-和AlO2-,X的电子式是_______。写出滤液1与过量气体X反应生成Al(OH) 3的离子方程式:_____________________。
(2)“熔烧”中反应之一是4Na2CO3+ 2Cr2O3+ 3O2 =4Na2CrO4+ 4X,该反应中被氧化的物质是______(填化学式);若该反应转移6mol电子,则生成_____mol Na2CrO4。
(3)“还原””中加入适量稀硫酸,调节pH=5,氧化产物为SO42-。写出离子方程式____________。
(4)已知该废料中含铬元素质量分数为a%,wt这样废料经上述流程提取mkgCr2O3。则该废料中铬元素回收率为_______(用代数式表示)。(已知回收率等于实际回收质量与理论质量之比)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )

A.和金属钠作用时,键①断裂
B.燃烧是全部化学键都断裂
C.在铜催化下和氧气反应时,键①和③断裂
D.和乙酸、浓硫酸共热时,键②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将1.92gCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL的NOX混合气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入标准状况下的O2的体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业生产过程中,涉及SO2转化为SO3的反应,某化学研究小组在450 ℃时,在一容积为10 L 的恒容密闭容器中研究该可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),得出的相关数据如表所示:
2SO3(g),得出的相关数据如表所示:
时间/min | n(SO2)/mol | n(O2)/mol | n(SO3)/mol |
0 | 0.200 | 0.100 | 0 |
10 | 0.190 | 0.095 | 0.010 |
15 | 0.160 | 0.080 | 0.040 |
20 | 0.160 | 0.080 | 0.040 |
25 | 0.150 | 0.150 | 0.050 |
根据表中数据,下列判断正确的是
A. 0~10 min内的反应速率可表示为v(SO2)=0.010 mol/(L·min)
B. 15~20 min内,正、逆反应速率不相等
C. 工业上常用增加SO2的量来提高O2的转化率
D. 20~25 min内,数据变化的原因可能是增加了O2的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com