
| 电解 |
| A、G、Y、Q、Z、X |
| B、X、Z、Q、G、Y |
| C、X、Z、Q、Y、G |
| D、G、Q、Y、Z、X |
| 电解 |


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
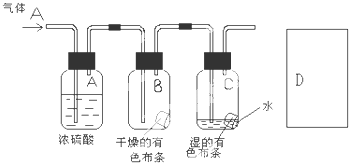
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
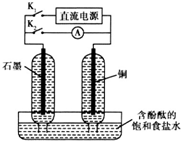 某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )
某兴趣小组设计如图微型实验装置.实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转.下列有关描述正确的是( )| A、断开K2,闭合K1时,铜电极为阳极 |
| B、断开K2,闭合K1时,石墨电极附近溶液变红 |
| C、断开K1,闭合K2时,铜电极发生还原反应 |
| D、断开K1,闭合K2时,石墨电极作正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、易溶与难溶固体混合物用溶解过滤方法提纯 |
| B、沸点不同的互溶液体可用蒸馏分离 |
| C、用酒精可以从碘水中萃取碘 |
| D、汽油和水的混合物可以用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(m+2.28)g |
| B、(m+2.04)g |
| C、(m+3.32)g |
| D、(m+4.34)g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| A、3 | B、4 | C、5 | D、6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com