
共价键、离子键都是构成物质微粒间的不同相互作用,同时含有上述两种相互作用是
A.CO2 B.NaOH C.Na2O2 D.NH4Cl
科目:高中化学 来源: 题型:阅读理解
 (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
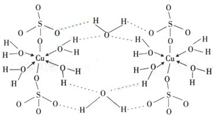 (2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.
(2010?陕西模拟)由CO与H2催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省丹东市宽甸二中高二上学期期末考试化学试卷(带解析) 题型:单选题
下列说法正确的是
| A.电负性最大的原子价电子构型:3S23p5 |
| B.N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型 |
| C.共价键和离子键都既有方向性又有饱和性 |
| D.根据VSEPR理论判断SF6空间构型为 正八面体 |
查看答案和解析>>
科目:高中化学 来源:2014届辽宁省丹东市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.电负性最大的原子价电子构型:3S23p5
B.N3-、CO2和O3互为等电子体,所以它们空间构型都是直线型
C.共价键和离子键都既有方向性又有饱和性
D.根据VSEPR理论判断SF6空间构型为 正八面体
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com