
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为_________。
(3)PO43-的中心原子的杂化方式为_________,该离子的空间构型为_________,键角为________,其等电子体有_________ (请写出两种)。
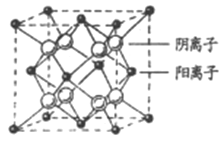
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为_________;已知Ca2+和F半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________g·cm3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为_________,原因为___________。
【答案】+2 [Ar]4s2 F>O>P sp3 正四面体形 109°28′ SO42-、CCl4等 12 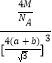 MgO>CaO Mg2+半径比Ca2+小,晶格能较大
MgO>CaO Mg2+半径比Ca2+小,晶格能较大
【解析】
根据处于同一电子层内相邻电子的电离能相差不大,不同电子层内相邻电子的电离能相差较多分析;结合原子核外电子排布规律书写其基态原子电子排布式;利用元素的非金属性越强,电负性越大,分析该物质中的元素电负性大小;根据微粒的空间构型、等电子体概念分析判断PO43-的结构,并学会运用晶胞结构中微粒的相对位置,判断微粒距离及晶体密度大小,利用微粒半径大小分析物质的硬度和熔沸点关系,据此解答。
(1) 根据元素M的气态原子的第I1-I5电离能大小可以看出:I1、I2相差不大,二I2、I3电离能相差较多,说明M原子最外层有2个电子。在Ca5(PO4)3中元素有Ca、P、O三种元素,只有Ca元素最外层有2个电子,原子半径大,容易失去最外层的2个电子,化合价为+2价;根据原子核外电子排布规律可知Ca基态原子电子排布式为[Ar]4s2或写为1s22s22p63s23p64s2;
(2)Ca3(PO4)3F中非金属元素有P、O、F三种,元素的非金属性F>O>P,元素的非金属性越强,其电负性就越大,所以按电负性由大到小的顺序排列为F>O>P;
(3) PO43-的中心原子P的价层电子对数是4,故P原子杂化为sp3杂化;由于孤对电子对数为0,该离子的空间构型为正四面体形,键角为109°28′,其等电子体有SO42-、CCl4;
(4)根据CaF2晶胞结构可知:在每个晶胞中与Ca2+离子距离最近且等距离的Ca2+有3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算了2次,所以与Ca2+离子距离最近且等距离的Ca2+有(3×8)÷2=12个;将CaF2晶胞分成8个小正方体,正方体中心为F-离子,顶点为Ca2+,晶胞中共有4个钙离子、8个氟离子。立方体的对角线为2(a+b),则晶胞的对角线为4(a+b),晶胞的边长为![]() ,根据晶体密度计算公式可得该晶体的密度
,根据晶体密度计算公式可得该晶体的密度![]() =
=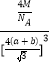 g/cm3;
g/cm3;
(5)MgO与CaO的晶体结构相似,由于离子半径Ca2+>Mg2+,离子半径越大,与O2-形成的离子键的键长就越大,晶格能就越小,物质的硬度就越小,故其摩氏硬度的大小关系为MgO>CaO。


科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y,发生反应:mX(g)![]() nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
1L | 2L | 4L | |
100℃ | 1.00mol/L | 0.75mol/L | 0.53mol/L |
200℃ | 1.20mol/L | 0.90mol/L | 0.63mol/L |
300℃ | 1.30mol/L | 1.00mol/L | 0.70mol/L |
下列说法正确的是( )
A. m>n
B. Q<0
C. 温度不变,压强增大,Y的质量分数减少
D. 体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。Q点时欲使溶液恢复到起始状态,可向溶液中加入
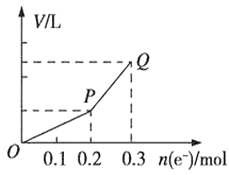
A. 0.1 mol CuO
B. 0.1 mol CuCO3
C. 0.1 mol Cu(OH)2
D. 0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,互为同系物的是
A. CH3CH=CH2与CH3CH3B.  与
与 ![]()
C. CH3CH2OH 与CH2OHCH2OHD. C3H8和C5H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A的相对分子质量为84。回答下列问题:
(1)烃A的分子式为_________。下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不变的是_____;若总质量一定,充分燃烧消耗氧气的量不变的是____。
A. C7H8 B.C6H14 C.C7H14 D.C8H8
(2)若烃A为链烃,分子中所有的碳原子在同一平面上,该分子的一氯取代物只有一种。则A的结构简式为__________。若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为__________ 。若烃B的相对分子质量比烃A小6,且B为最简单芳香族化合物,写出B与浓硝酸,浓硫酸混合共热的化学方程式__________
(3)如图:

①该物质与足量氢气完全加成后环上一氯代物有________种;
②该物质和溴水反应,消耗Br2的物质的量为_______mol;
③该物质和H2加成需H2________mol;
(4)如图是辛烷的一种结构M(只画出了碳架,没有画出氢原子)按下列要求,回答问题:

①用系统命名法命名________。
②M的一氯代物有________种。
③M是由某烯烃加成生成的产物,则该烯烃可能有_______种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g),是工业制硫酸的主要反应之一。
2SO3(g),是工业制硫酸的主要反应之一。
(1)该反应过程的能量变化如图所示:

由图中曲线变化可知,该反应为______(填“放热”或“吸热”)反应。该反应通常用V2O5作催化剂,加入V2O5后,改变的是图中的_____。
A.△H B.E C.△H-E D.△H+E
(2)在2L绝热密闭容器中投入2molSO2和bmolO2,下图是部分反应物随时间的变化曲线。

①10min时,v(SO3)=_____。
②反应达到平衡时,SO2的转化率为______。
③下列情况能说明该反应达到化学平衡的是_____
A. v(SO3)=v(SO2) B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变 D.混合气体的总物质的量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com