
【题目】亚硝酸和亚硝酸盐在生产、医药等领域有着广泛应用。某校化学兴趣小组用下图所示仪器(夹持装置已省略)及药品,探究硫酸与亚硝酸钠反应生成气体的成分。已知NO2和NO液化温度分别为21 ℃和-152 ℃。
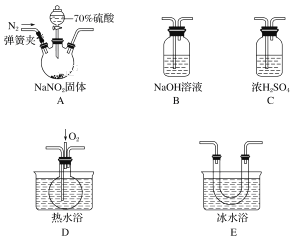
(1)A中盛放70%硫酸的仪器名称为___________________,反应前通入氮气的目的是_______________________________________________;仪器的连接顺序(按左→右连接)为A→________→________→________→B;
(2)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。确认A中产生的气体含有NO,依据的现象是__________________________________;
(3)装置A中反应的化学方程式为________________________________;
(4)如果没有装置C,对实验结论造成的影响是________________________。
【答案】 分液漏斗 排尽装置内的空气,防止产生的NO被氧化成NO2,造成对A中反应产物检验的干扰 C E D 装置D中通入氧气后会出现红棕色气体 2NaNO2+H2SO4===Na2SO4+NO↑+NO2↑+H2O 水蒸气会与NO2反应产生NO,造成对NO的来源认识不清
【解析】(1)根据仪器构造可知A中盛放70%硫酸的仪器名称为分液漏斗;硫酸与亚硝酸钠反应生成气体的成分为NO、NO2,其中NO与空气中的氧气反应被氧化成NO2,所以实验开始前要将装置中的空气排尽,反应前通入氮气的目的是排尽装置内的空气,防止可能产生的NO被氧化成NO2,造成对A中反应产物检验的干扰,根据各部分装置的作用可知,C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用D检验NO,所以仪器的连接顺序为A→C→E→D→B;(2)无色的NO与氧气反应生成红棕色的二氧化氮,所以确认A中产生的气体含有NO,依据的现象是装置D中通入氧气后会出现红棕色气体;(3)装置A中为硫酸与亚硝酸钠反应生成硫酸钠、NO、NO2和水,反应方程式为2NaNO2+H2SO4=Na2SO4+NO↑+NO2↑+H2O;(4)C装置主要作用是干燥混合气体,如果有水,二氧化氮与水反应生成一氧化氮,所以如果没有装置C,水蒸气会与NO2反应产生NO,造成对NO的来源认识不清。


科目:高中化学 来源: 题型:
【题目】山东半岛蓝色经济区的建立使海洋经济将成为山东经济转型升级发展的重点。下列说法正确的是
A.从海水中提取溴单质的过程中涉及氧化还原反应
B.从海带中提取碘单质的过程中只涉及复分解反应
C.从海水中提取镁单质的过程中要涉及置换反应
D.从海水中提取氯化钠的过程中涉及化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:Fe2+、NO![]() 、SO
、SO![]() 、Na+
、Na+
B. 由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO![]()
C. c(H+)/c(OH-)=1012的溶液中:NH![]() 、Al3+、NO
、Al3+、NO![]() 、Cl-
、Cl-
D. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO![]() 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合不正确的有( )
①海水、空气、胆矾、盐酸均为混合物;
②H2CO3、CH3COOH、H2SO4、H2S均为酸;
③Mg(OH)2、NaOH、Cu2(OH)2CO3、NH3H2O均为碱;
④干冰、N2O5、SiO2、H2O均为酸性氧化物;
⑤NaHSO4、AgCl、AlCl3、CaCO3均为盐;
⑥NaH2PO4、Na2SO4、纯碱既为钠盐,同时又为含氧酸盐。
A. ①③④⑥ B. ①③④ C. ①②③⑤⑥ D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+ F2(g)===2HF(g)的能量变化如图所示,下列有关叙述中正确的是( )

A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H—H键和1 mol F—F键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
硫铁矿
![]()
![]()
![]()
![]()
![]()
 Na2S2O3·5H2O
Na2S2O3·5H2O
已知:Ⅰ.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
Ⅱ.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是_______________________________。
(2)吸收塔中的原料B可以选用________(填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。

①使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是____________________。装置B的作用是______________________。
②C中制备Na2S2O3发生的连续反应的化学方程式有Na2S+H2O+SO2===Na2SO3+H2S、2H2S+SO2===3S↓+2H2O (或)2H2S+H2SO3===3S↓+3H2O和___________________________________。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用I2O5可消除CO污染,反应为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是
5CO2(g)+I2(s)。不同温度下,向装有足量的I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2 的体积分数ψ(CO2)随时间t变化曲线如右图,下列说法正确的是

A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5min反应速率v(CO)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
![]()
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com