
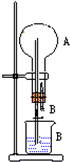
 在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.
在图装置中,烧瓶中充满干燥气体A,将滴管中的液体B挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹,尖嘴管有液体呈喷泉状喷出,最终几乎充满烧瓶.| A | B | 喷泉颜色 | |
| 途经1 | |||
| 途经2 | |||
| 途经3 |
分析 (1)酸遇紫色石蕊变红;
(2)CO2在NaOH溶液中发生反应:CO2+2NaOH═Na2CO2+H2O,烧瓶中压强减小,形成喷泉;
Cl2在NaOH溶液中发生Cl2+2NaOH═NaCl+NaClO+H2O,能形成喷泉;
NH3极易溶于水,溶液显碱性,遇酚酞变红.
解答 解:(1)若A为HCl气体,B为石蕊试液,则形成红色喷泉,故答案为:石蕊;
(2)CO2在NaOH溶液中发生反应:CO2+2NaOH═Na2CO2+H2O,烧瓶中压强减小,形成喷泉,则A为CO2,B为NaOH;
Cl2在NaOH溶液中发生Cl2+2NaOH═NaCl+NaClO+H2O,能形成喷泉,则A为Cl2,B为NaOH;
NH3极易溶于水,溶液显碱性,遇酚酞变红,则A为NH3,B为水,且烧杯中滴加酚酞,可形成红色喷泉,
故答案为:
| A | B | 喷泉颜色 | |
| 途经1 | CO2 | NaOH | 无色 |
| 途经2 | Cl2 | NaOH | 无色 |
| 途经3 | NH3 | H2O | 红色 |
点评 本题考查实验方案的评价及实验装置的应用,为高频考点,侧重于学生的分析与实验能力的考查,注意把握产生喷泉的条件:气体在液体中的溶解度很大(或气体与液体能发生反应),烧瓶内外产生足够的压强差,题目难度不大.


科目:高中化学 来源: 题型:选择题
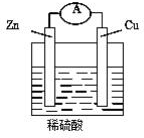 如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )
如图,将锌片和铜片用导线连接后加入稀硫酸溶液中,发生原电池反应,下列叙述错误的( )| A. | 锌是负极,锌片逐渐溶解 | B. | 铜是正极,铜片上有气泡产生 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 电子从锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是原子的实际质量 | B. | 是质子数加中子数 | ||
| C. | 标准是碳-12原子质量的$\frac{1}{12}$ | D. | 相对原子质量的单位是Kg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何钠盐放人水中均不水解 | |
| B. | 可溶性铝盐溶于水都能水解 | |
| C. | NaC1水解后溶液呈中性 | |
| D. | NaHCO3溶液中只存在水解平衡不存在电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硫酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 酸化的硫酸亚铁溶液中加入双氧水:Fe2++2H2O2═2Fe3++2H2O | |
| D. | 在氢氧化镁浑浊液中滴加氯化铁溶液:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
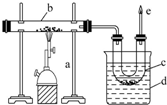 图是实验室干馏煤的装置图,回答下列问题:
图是实验室干馏煤的装置图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com