
【题目】有下列仪器:①漏斗;②锥形瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;⑦燃烧匙。其中常用于分离物质的仪器是 ( )
A. ①③④B. ①②⑥C. ①③⑤D. ③④⑦
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 量筒量取20.0mL 0.500 mol·L-1 H2SO4溶液于烧杯中,加80 mL水配制成0.100 mol·L-1H2SO4溶液 B. 用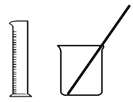 配制100 mL 0.100 0 mol·L-1 KMnO4溶液
配制100 mL 0.100 0 mol·L-1 KMnO4溶液
C. 固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 D. 1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系: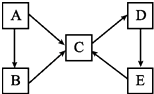
(1)若A为单质,C、D的相对分子质量相差16,0.05 molL﹣1 E溶液中只有3种离子,且在25℃时,溶液中的 ![]() =1012 . ①若B为气态氢化物,写出E→C的一个化学方程式 .
=1012 . ①若B为气态氢化物,写出E→C的一个化学方程式 .
②在A→C的反应中,每转移1 mol e﹣就会放热143.5 kJ,写出该反应的热化学方程式 .
(2)若A为单质,B、C均属于盐类,D是一种白色沉淀.①若B的水溶液呈酸性,C的水溶液呈碱性,C溶液呈碱性的原因是(用离子方程式表示).
②若B溶液呈黄色,与硫氰化钾溶液混合后显红色,E是一种不溶性碱.则:
(Ⅰ)B→C的离子方程式为 .
(Ⅱ)D→E的化学方程式为 .
(Ⅲ)选用一种试剂R与E反应实现E→C的转化,则R为;该反应的离子方程式为 .
(3)若A~E均为化合物,且均含有元素Y.A是淡黄色固体,B、C两溶液在等物质的量浓度时,C溶液的pH较小.电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法.Y的单质与钾的合金可在核反应堆中用作热交换液.5.05 g Y钾合金溶于200 mL水生成0.075 mol氢气,计算并确定该Y钾合金的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3 ![]() HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
HCO3﹣ , 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒.其pH随c(HCO3﹣):c(H2CO3)变化关系如下表:
c(HCO | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO ![]() )
)
D.pH=7.40的血液中,HCO ![]() 的水解程度一定大于H2CO3的电离程度
的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室可用KMnO4和浓盐酸反应制取氯气。
2KMnO4+16HCl(浓) ![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥标出电子转移的方向和数目。____________________
(2)将上述配平的化学方程式改写为离子方程式__________________________________ 。
(3)浓盐酸在反应中显示出来的性质是________________
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)若产生0.5molCl2,则被氧化的HCl________mol,转移的电子的数目约为____________。
II.根据反应Cu+4HNO3(浓)![]() Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原产物是______。
②氧化剂与氧化产物的物质的量之比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A.0.3 mol?L﹣1的Na2SO4溶液中含有的Na+和SO ![]() 的总物质的量为0.9 mol
的总物质的量为0.9 mol
B.当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol?L﹣1 , 只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol?L﹣1
C.在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42﹣的物质的量相等,则K+和Cl﹣的物质的量浓度一定相同
D.10℃时,0.35 mol?L﹣1的KCl饱和溶液100 mL蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol?L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLBaCl2、AlCl3、FeCl3 的混合溶液A中逐滴加入Na2SO4和NaOH的混合溶液B,产生沉淀的物质的量n和加入溶液B的体积关系如图所示: 
(1)当加入110mLB溶液时,溶液中的沉淀是(填化学式).
(2)溶液B中Na2SO4和NaOH的物质的量浓度之比是 . 当B溶液加到90mL~100mL这一段时间中,所发生的离子反应方程式是
(3)将A、B溶液中各溶质的物质的量浓度(c)填入下表中.
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c/molL﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3:4,不能与溴水反应却能使酸性KMnO4溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在铁存在时与溴反应,能生成两种一溴代物.该有机物可能是( )
A.CH≡C﹣CH3
B.![]()
C.CH2═CHCH3
D.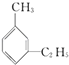
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列各组化合物:
A.CH3CH2CH2CHO与 ![]()
B. ![]() 与
与 ![]()
C. ![]() 与
与 ![]()
D.CH3CH2C≡CH与CH2=CH﹣CH=CH2
E. ![]() 与
与 ![]()
F.戊烯和环戊烷
①属于同系物的有 , 属于同分异构体的有 .
②根据官能团的特点可将C中两化合物分别划分为类和类.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com