
| 2.24L |
| 22,4L/mol |
| 1 |
| 3 |


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:

| A、图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图象 |
| B、图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g |
| C、图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同 |
| D、图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z与Y、Z与W形成的化合物的化学键完全相同 |
| B、Y、Z、W三种元素组成的化合物的水溶液可能显碱性 |
| C、简单离子的半径:Z>R>W>Y |
| D、因非金属Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,8g CH4含有4NA个氢原子 |
| B、1L 0.1 mol?L-1 (NH4)2SO4溶液中含有0.2NA个NH4+ |
| C、1mol Cu与足量FeCl3溶液反应,转移2NA个电子 |
| D、标准状况下,2.24L氮气含有0.1NA个N2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合物:CaCl2、烧碱、聚苯乙烯、HD | ||||||
| B、电解质:明矾、胆矾、冰醋酸、硫酸钡 | ||||||
| C、同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 | ||||||
D、同位素:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 ; ⑥
; ⑥ 和
和 ⑦CH3(CH2)3CH3和
⑦CH3(CH2)3CH3和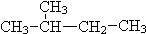
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从左到右,原子半径逐渐增大 |
| B、从左到右,元素原子氧化性减弱,还原性增强 |
| C、从左到右,元素最高正价从+1递增到+7(O,P除外),负价由-4递变到-1 |
| D、从左到右,元素最高价氧化物对应的水化物的碱性增强,酸性减弱(O,F除外) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5-3 | +7-1 | +5-3 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com