
【题目】下表是元素周期表的一部分,有关说法不正确的是( )
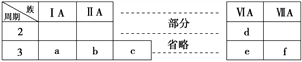
A. 元素b的单质不能与酸性氧化物发生化学反应
B. a、b、d、f四种元素的离子半径:f>d>a>b
C. 元素c的氧化物既能与酸反应又能与碱反应
D. a、c、e的最高价氧化物对应的水化物之间能够相互反应
科目:高中化学 来源: 题型:
【题目】某化工厂生产化工原料的同时会产生多右种废液,其有机废液的主要成分为苯胺、苯酚、苯甲醇(都微溶于水),其无机废液的主要污染成分为Cr2O72-,该工厂处理废液的方法如下:
I.利用物质的酸碱性,从有机废液中分离、回收有机物
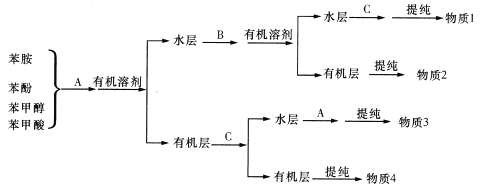
(1)物质A为______,物质B为______, 物质C为_________。(填写化学式)
(2)若想选用一种试剂仅仅将苯甲酸与其他种物质分开,则应选用的试剂是______。
II.利用纳米级Cu2O处理含有Cr2O72-的酸性废水
已知:Cu2O![]() Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
Cu+CuSO4;pH=5时Cr3+会形成Cr(OH)3沉淀
(3)工业上用肼(N2H4)与新制的Cu(OH)2反应制备纳米级Cu2O,同时放出N2,该反应的化学方程式为____________。
(4)光照时,会在形成的微电极上发生电极反应,反应原理如下图所示,

对Cu2O的作用提出两种假设:
a. Cu2O作光催化剂;
b. Cu2O与Cr2O72-发生氧化还原反应
己知:Cu2O的添加量是1.74×10-4mol/L,Cr2O72-的初始浓度是9.60×10-4mol/L;对比实验,反应1.5小时结果如右图所示。结合试剂用量数据和实验结果可得到的结论是假设_____成立,写出该过程的正极反应方程式:_______________。
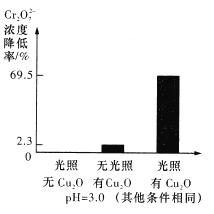
(5)溶液的pH对Cr2O72-降解率的影响如下图所示。

由上图可知,pH=3时,Cr2O72-的降解率最大;pH=2与pH=5时,Cr2O72-的降解率低的原因分别可能是___________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铜样品的主要成分为a CuCO3·bCu(OH)2(a、b均为最简正整数)。为测定其化学组成和Cu元素的质量分数。甲乙两个实验小组查阅资料,设计了不同的实验方案(假定杂质对实验无干扰)。
Ⅰ.甲组同学利用一下方法测定:
①在一定质量的样品中加入过量的稀硫酸,过滤,测量产生气体的体积
②在滤液中加过量的NaOH稀溶液,过滤
③灼烧②中所得滤渣、直至残留固体恒重
(1)为了除去滤渣中的可溶性杂质,需要对滤渣进行的操作是_____,滤渣应在_____(填仪器名称)中进行灼烧。
(2)利用右图装置测量气体体积,读数时应注意:
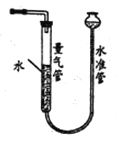
①恢复至室温;②__________;③平视且视线与凹液面最低点相切。
若操作无误,但气体体积测量结果仍然明显偏低,合理的改进措施是____________。
(3)甲组同学在处理实验数据时,将常温常压下测得的气体体积VL换算成V/22.4mol进行计算,则计算所得a值将_______(填“偏大”、“偏小”或“无影响”)。
Ⅱ.乙组同学利用下图装置进行测量(夹持及加热装置略去):
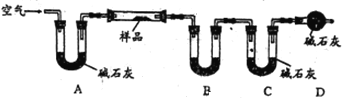
(4)U型管B中的药品是_________,D的作用是_________。
(5)若样品的质量为20g,充分反应后测得B中固体质量增加了0.9g,C中固体质量增加了4.4g,则样品中主要成分的化学式为___________,样品中铜元素的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号中的物质是除去杂质所需的药品,其中错误的是( )
A.NaCl溶液中有杂质Na2SO4(氯化钡)
B.FeSO4溶液中有杂质CuSO4(铁粉)
C.生石灰中混有少量石灰石(盐酸)
D.BaCl2溶液中有少量MgCl2(氢氧化钡)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A相对分子质量为140,其中碳的质量分数为85.7%。A分子中有两个碳原子不与氢原子直接相连。A在一定条件下氧化只生成G,G能使紫色石蕊试液变红。已知:

请回答下列问题:
⑴A的结构简式____________________ G的结构简式:____________________。
⑵G的酯类同分异构体(不含立体异构)有_____________________种,写出其中核磁共振氢谱中有三种峰,且峰的面积之比等于6:3:1的结构简式 ___________________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分

(1)①~⑦元素中金属性最强的元素是___________(用元素符号表示)。
(2)④与⑤形成的化合物的电子式为____________。
(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(4)表中元素②的单质与③的最高价含氧酸的浓溶液反应的化学方程式为___________________。
(5)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为垃,该元素在元素周期表中的位置是_____________,属于______元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______。
(6)核内中子数为N的R![]() ,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。
,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com