

分析 (1)该实验用溴化钠固体和硫酸反应生成溴化氢,溴化氢与乙醇发生取代生成溴乙烷,配制体积比1:1的硫酸,为粗略配制,据此选择仪器;
(2)加热时溴化钠与硫酸反应生成HBr,HBr与乙醇发生取代反应生成溴乙烷;
(3)生成物为溴乙烷,溴乙烷的沸点为38.4°C,溴乙烷难溶于水,冷水可以将溴乙烷蒸气变成液态溴乙烷;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,a.溴和溴乙烷都易挥发,用蒸馏的方法很难将溴除去;
b.氢氧化钠溶液易使溴乙烷水解;
c.溴和溴乙烷都能溶于四氯化碳溶液;
d.亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离;
在加热温度较高时,乙醇发生消去反应生成乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,都会腐蚀橡胶.
解答 解:(1)该实验用溴化钠固体和硫酸反应生成溴化氢,溴化氢与乙醇发生取代生成溴乙烷,配制体积比1:1的硫酸,为粗略配制,量取溶液的体积要求精确度不是很高,可用量筒量取,故答案为:蒸馏瓶,b;
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,反应的化学方程式为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O,
故答案为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O;
(3)冰水混合物温度较低,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,
故答案为:冷却、液封溴乙烷; 3;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,
故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,在加热温度较高时,乙醇发生消去反应生成乙烯,
a.溴和溴乙烷都易挥发,用蒸馏的方法很难将溴除去,故a错误;
b.氢氧化钠溶液易使溴乙烷水解,故b错误;
c.溴和溴乙烷都能溶于四氯化碳溶液,故c错误;
d.亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,故d正确,
故选d;在加热温度较高时,乙醇发生消去反应生成乙烯,乙烯能使高锰酸钾褪色,
故答案为:d;乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶,应用玻璃导管,
故答案为:反应会产生Br2,腐蚀橡胶.
点评 本题主要考查溴乙烷制备、提纯、有机反应等知识,侧重于学生的分析、实验能力的考查,掌握相关物质的基本化学性质并熟悉该装置和反应原理是解答本题的关键,平时须注意积累相关反应知识,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与果糖、淀粉和纤维素分别为同分异构体 | |
| B. | 若某有机物在氧气中充分燃烧生成CO2和H2O物质的量相等,则该有机物是乙烯 | |
| C. | 燃烧乙烷、环丙烷(C3H6)混合气体,所产生的CO2的量一定小于燃烧相同质量的丙烯所产生的CO2 | |
| D. | 相同质量的乙烯和乙醇在氧气中充分燃烧,消耗的氧气相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
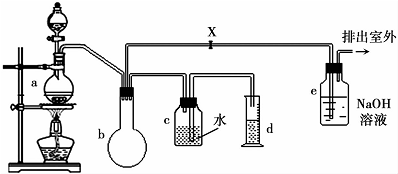
| 名称 | 熔点 | 沸点 | 溶解性 |
| 一氯甲烷 | -97.73℃ | -24.2℃ | 18℃时在水中微溶,与乙醚、丙酮或苯互溶,能溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
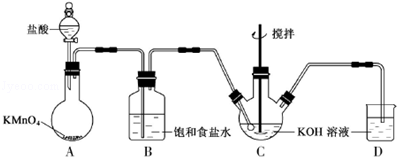
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2 | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
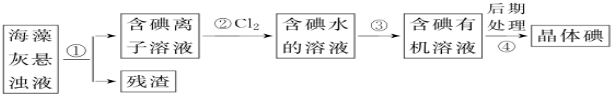
| A. | 步骤①、③的操作分别是过滤、萃取 | |
| B. | 可用硝酸银溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是裂化汽油或四氯化碳 | |
| D. | 步骤④的操作是过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
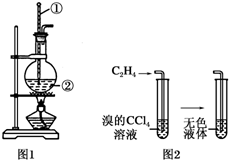 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2↑+H2O,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA | |
| D. | 1L1 mol•L-1FeCl3完全水解生成NA个胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素的最高正价均等于其族序数 | |
| B. | 第2周期第ⅣA族元素的原子,核电荷数和中子数均为6 | |
| C. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| D. | 非金属元素的气态氢化物溶于水后,水溶液均呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com