
ij��Һ����Fe2+��Na+��Al3+��Ba2+��SO42-��NO3-��Cl-�е�4�����ӣ��������ӵ����ʵ�����Ϊ1mol���������Һ�м��������ϡ���ᣬ�����ݲ���������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ����
A���������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ� �������ù��������Ϊ72g
B���������Һ�м��������ϡ���ᣬ�����������������ܱ�ɺ���ɫ
C���������Һ�м��������ϡ�����KSCN��Һ����Һ��Ѫ��ɫ
D������Һ�������������ǣ�Fe2+��Na+��SO42-��NO3-

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ�����и�����ѧ��10�½β⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪NH4CuSO3��������ϡ�������ȣ�������������:���к�ɫ�������ɣ����д̼�����ζ�������������Һ����ɫ���ݴ��ж�����˵����ȷ����
A����Ӧ��������������
B��NH4CuSO3��SԪ�ر�����
C���̼�����ζ�������ǰ���
D��1 mol NH4CuSO3��ȫ��Ӧת��0. 5 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������������ʦ���и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ��ƶ���
A��H��Ϊ������Ԫ�أ�A��F��Ԫ�����ڱ��е����λ����ͼ��ʾ��G����������Ԫ�ز���ͬһ���ڣ�H�Ƕ�������ԭ�Ӱ뾶��������Ԫ�ء���B��G��ɵ���̬�������ˮ��Һ�ʼ��ԡ�
A | B | C | |
D | E | F |
��ش��������⣺
��1��д���ĵ���ʽ ��ʵ������ȡ����Ļ�ѧ����ʽΪ ��
��2��B��C��G������Ϊ1:1:5�γɵĻ�����Ļ�ѧ������Ϊ ��
A�����Ӽ� B�� ���Լ� C�� �Ǽ��Լ�
��3�����õ���ʽ��ʾAE2���γɹ��� ��
��4�������ӷ��ű�ʾC��E��F��H�������ӵİ뾶�ɴ�С��˳�� ��
��5����һ�����ӷ���ʽ����A��D�ǽ�����ǿ��ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
NH3����Ҫ�Ļ���ԭ�ϡ�
��1����NH4Cl��Ca(OH)2�Ʊ�NH3����Ӧ�����������ռ���β������װ������Ϊ ��
��2��ijѧ������ͼװ�ö�NH3��NaClO�ķ�Ӧ����ʵ��̽����
���� | ���� |
| Һ���Ϸ����ְ��� |
���ϣ����ʹ���������Һ��Ӧ�������¡��³���������ɫҺ�壬�е㣺113�棬��ˮ���ܣ�����ˮ��Һ��һ�ֶ�Ԫ���
����ˮ�г���ͨ��NH3��δ�۲쵽�������Ʋ������еİ�����N2H4СҺ���γɣ�����ʵ�飺��ʪ��ĺ�ɫʯ����ֽ�����������ֽ��������ʵ�鲻���жϰ����к���N2H4�������� ��
�ڽ�һ��ʵ��ȷ����A��������N2H4��д��A�з�Ӧ�Ļ�ѧ����ʽ��N2�����뷴Ӧ�� ���˷�Ӧ������5.6L��������״���£��μӷ�Ӧ����ת�Ƶ��ӵ���ĿΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꼪��ʵ����ѧ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��˵��0.1mol•L��1��NaHA��Һһ�������Ե��ǣ� ��
A�� ij�¶��£������Һ��pH��7
B����Һ��c��Na+��=c��A2����
C����Һ�д���Na+��HA����A2����H2A ������
D��NaHA��Һ�������������ʵ���Ũ�ȵ�NaOH��Һǡ�÷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������������һ��ѧ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ������������ͼ��ʾװ�ý����й�ʵ�飺
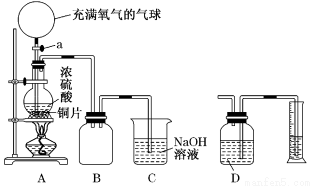
��1���ȹرջ���A����6.4 gͭƬ��12 mL 18 mol/L��Ũ�������Բ����ƿ�й�������Ӧ��ɣ�������ƿ�л���ͭƬʣ�࣮�ٴ���A���������е�������������Բ����ƿ�����ͭƬ��ȫ��ʧ��
��д��������������ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽ��
����A֮ǰ ��
����A֮�� ��
��B�������ռ�ʵ���в����������װ�ã�������ƿ�ڵĵ���δ��ȫ����������������ΰѵ��ܲ������� ��
��2��ʵ���ϣ��ڴ���A֮ǰ��������ʣ�ࡣΪ�����ⶨ��������ʵ������ס�����ѧ��������������ƣ�
�ټ�ѧ����Ʒ����ǣ��Ȳⶨͭ��Ũ���ᷴӦ����SO2��������ͨ������ȷ����������ʵ��������ⶨSO2�ķ����ǽ�װ��A���������建��ͨ��װ��D���Ӷ����װ��A��������������������ɱ�״����������Ϊ��ѧ����Ƶ�ʵ�鷽����Dװ�����Լ�Ϊ�� ���ѧʽ����
����ѧ����Ƶķ����ǣ�����Ӧ�����Һ��ȴ��ȫ�����뵽�ձ���ϡ�ͣ�������ȷ������100 mL��Һ����ȡ20 mL����ƿ�У��� ��ָʾ�����ñ�����������Һ���еζ�[��֪��Cu��OH��2��ʼ������pHԼΪ5]��ѡ���ָʾ��������Ϊ ���������������ʵ���������ȥA mol/L����������ҺB mL����ԭ��������ʵ���Ϊ mol���ú�A��B�ı���ʽ����ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016����������ɽ����ѧ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
ij��ҵ��ˮ�п��ܺ������¼����������ӣ�
������ | Fe3+��Al3+��Fe2+��Ba2+��Na+ |
������ | Cl����CO32����NO3����SO42����SiO32�� |
�ֶԸ÷�ˮ��Ʒ���������о���
��ȡ�����ķ�ˮ���Թ��У��۲���ɫ������ζ������ͨˮ���Բ�ͬ��
�����Թ��еμ�Ũ���ᣬ����������ɫ�������ɣ�����������������Ϊ����ɫ��
������II���õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�
��������II���õ���Һ�м��������NaOH��Һ���к��ɫ�������ɡ����˺���������Һ��ͨ�������CO2���壬�а�ɫ��״�������ɡ�
��������ʵ�飬�ش��������⣺
��1���÷�ˮ��һ�����е��������� ��һ�������е��������� ��
��2��д��IV��������Һ��ͨ�������CO2�������ɰ�ɫ��״���������ӷ���ʽ��ֻд��һ������ ��
��3��������ˮ�е���Ԫ����ȫת����Fe3+����ʱ���c(Fe3+����1��0��10��2mol��L��1��Ҫ�뽫��ת��ΪFe(OH��3��������ȥ����Ӧ������ҺpHԼΪ ������֪������Fe(OH��3��Ksp��1��0��10��38��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016�㽭����Чʵ��ѧ�߶������п��Ի�ѧ�Ծ����������棩 ���ͣ�ѡ����
�����£��й�����������Һ��������ȷ���ǣ�������Һ��ϵ�����仯��
�� | �� | �� | �� | |
pH | 12 | 12 | 2 | 2 |
��Һ | ��ˮ | ����������Һ | ���� | ���� |
A���ڢ١����зֱ�����Ȼ�茶��壬����Һ��pHֵ������
B���ֱ�����Ģٺ͢ڼ�ˮϡ��100����������Һ��pH����>��
C���Ѣ١�������Һ�������Ϻ�������Һ������
D������Һ�ں���Һ�۵������ϣ���Ϻ�������ҺpH=7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ��̨�и�����ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
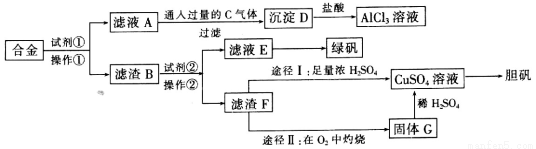
ij����С��̽�����÷ϺϽ�(������������ͭ)��ĩ��ȡ�������Ȼ�����Һ���̷�����͵������壬��ʵ�鷽�����£�
�Իش��������⣺
��1�������Լ��١��ڷֱ���___________��____________��
��2�������ٵ�����Ϊ__________�����õ�����������̨����Ȧ���ձ�������Ҫ����Ʒ��______________��
��3��д��A��D��Ӧ���ӷ���ʽ____________��
��4����ҺE������Ũ����_________���̷����壬Ȼ���پ����ˡ�ϴ�ӡ����T�ó�Ʒ��ϴ��ʱ�������Լ����ѡ��___________��
a��ϡH2SO4 b������ˮ c���ƾ� d��NaOH��Һ
��5��������F��CuSO4��Һ��;��I��;�������֣�����Ϊ���;����________��������_________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com