
���� ��1����Ԫ�ػ��ϼ۵ĽǶ��жϣ�������ԭ��Ӧ�У��������ڷ�Ӧ�еõ��ӱ���ԭ������Ԫ�ػ��ϼ۽��ͣ���ԭ��ʧ���ӣ�����Ԫ�ػ��ϼ����ߣ�
��2�����ݷ���ʽ�����㼴�ɣ�
��3�����ϼ۽��͵���Ԫ�����ڵ����������������ڷ�Ӧ�б���ԭ�����ݷ���ʽ�����㼴�ɣ�
��� �⣺��1����Ӧ����FeԪ�صĻ��ϼ����߱�������HԪ�ػ��ϼ۽��ͣ�����ԭ�õ���ԭ����ΪH2����Ӧ����CuԪ�صĻ��ϼ����߱�������CuΪ��ԭ����SԪ�ػ��ϼ۽��ͣ�����ԭ��
�ʴ�Ϊ��Fe��H2��Cu��S��
��2���赱��Ӧ������32g H2ʱ������H2SO4��������xg��
Fe+H2SO4��ϡ���TFeSO4+H2��
98 2
xg 32g
��x=$\frac{98��32g}{2}$=1568g��
�ʴ�Ϊ��1568��
��3��n��SO2��=$\frac{32g}{64g/mol}$=0.5mol���ɷ���ʽ��֪������2molH2SO4�μӷ�Ӧʱ����1mol����ԭ��1mol�������ԣ�����1molSO2��������0.5molSO2������1molH2SO4������Ϊ1mol��98g/mol=98g������0.5mol������������������Ϊ49g������0.5molSO2ʱ��S��+6�۽���Ϊ+4�ۣ�ת��1mol���ӣ�
�ʴ�Ϊ��98��49��1��
���� ���⿼��������ԭ��Ӧ�ļ��㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע�����������ԭ��Ӧ����������Ԫ�ػ��ϼ۵ĽǶ���ʶ��ظ�������ʵ����ʣ���Ϸ�Ӧ�ķ���ʽ���㣬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
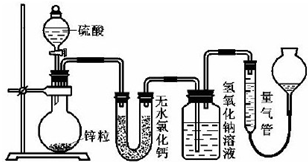
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ɫ | B�� | ��ɫ | C�� | ��ɫ | D�� | ���ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| pH��Χ | ��7 | ��7 |
| ���� | NO3- | NO��N2O��N2�е�һ�� |
| A�� | ���������£�NaNO2��NaClO��Ӧ�����ӷ���ʽΪNO2-+ClO-�TNO3-+Cl- | |
| B�� | �����NaNO2��Һ��ͨ��CO2�ɵõ�HNO2 | |
| C�� | �����NaNO2��Һ�м���ϡ����ɵõ�HNO2 | |
| D�� | �����NaNO2��Һ�м�����е��۵�����ᣬ��Һ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѹ�³�N2 | B�� | ��B | C�� | �����³�N2 | D�� | ��A |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
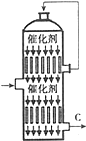 �����������ߵͳ����ں���һ�����һ�������ˮƽ�ĸߵͣ�
�����������ߵͳ����ں���һ�����һ�������ˮƽ�ĸߵͣ�| ѹǿ ��Pa�� �¶� ���棩 | 1.013��105 | 5.065��105 | 10.13��105 | 15.195��105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88��105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ԫ����ͬ�Ҹ�Ԫ����������Ҳ��ͬ��һ����Ϊͬ���칹�� | |
| B�� | ��Է���������ͬ���л���һ��Ϊͬ���칹�� | |
| C�� | ����ͬ�ķ���ͨʽ�ҷ�����������һ�������ɸ�CH2ԭ���ŵ�����һ����Ϊͬϵ�� | |
| D�� | �ṹ��ͬ���������ƣ���ѧʽ��ͬ�����ʻ���ͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=4�������У�c��H+��=4.0mol•L-1 | |
| B�� | NH4Cl��Һ�У�c��Cl-��=c��NH4+�� | |
| C�� | NaCl��Һ�У�c��Na+��+c��H+��=c��Cl-��+c��OH-�� | |
| D�� | Na2CO3��Һ�У�c��HCO3-��+c��H2CO3��+c��CO32-��=2c��Na+�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com