
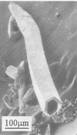
 最近,我国某高校一研究小组将0.383g AgCl,0.160g Se和0.21g NaOH装入充满蒸馏水的反应釜中加热到115℃,10小时后冷至室温,用水洗净可溶物后,得到难溶于水的金属色晶体A。在显微镜下观察,发现A的单晶竟是六角微型管(如右图所示),有望开发为特殊材料。现代物理方法证实A由银和硒两种元素组成,Se的质量几近原料的2/3;A的理论产量约0.39g。
最近,我国某高校一研究小组将0.383g AgCl,0.160g Se和0.21g NaOH装入充满蒸馏水的反应釜中加热到115℃,10小时后冷至室温,用水洗净可溶物后,得到难溶于水的金属色晶体A。在显微镜下观察,发现A的单晶竟是六角微型管(如右图所示),有望开发为特殊材料。现代物理方法证实A由银和硒两种元素组成,Se的质量几近原料的2/3;A的理论产量约0.39g。
1.写出合成A的化学方程式,标明A是什么。(3分)
2.溶于水的物质有:______________________________________。(2分)
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:022
我国某高校一研究小组将0.383g AgCl,0.160g Se,0.21gNaOH装入充满蒸馏水的反应釜中加热到115℃,10h后冷至室温,用水洗净可溶物后,得到难溶于水的金属色晶体A。在显微镜观察下,发现A的单晶竟是六用微晶管,有望开发为特殊材料。现代物理方法证实A由银和硒两种元素组成,Se的质量接近原料的![]() ;A的理论产量约0.39g。
;A的理论产量约0.39g。
(1) 写出合成A的化学方程式________;A为________(写化学式)。
(2) 溶于水的物质有________。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1) 写出合成A的化学方程式________;A为________(写化学式)。
(2) 溶于水的物质有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)雷雨天后,一同学取一杯外观浑浊的河水,他在水中加了几颗明矾晶体,搅拌后不一会儿,就变澄清透明,杯底有沉淀物。沉淀物的主要成分是___________,加明矾晶体搅拌后变澄清透明的原因是_________________________________。
(2)某同学家附近有一口老井,井中之水冬天温热、夏天冰凉,清澈无比。他从井中取了一杯清澈的井水到实验室里,加了几滴明矾溶液。结果观察到白色浑浊、少量无色气泡产生等现象。推测这口老井水为什么会有“冬温夏凉”的现象?清澈的井水中加明矾为什么会产生沉淀和气泡?
(3)假期时某同学到一农村的亲戚家去度假,由于那里还没装自来水,日常用水都是从村边的一口井里取来的。有一次他偶然发现,头一天取回的清澈井水表面产生了一层暗红色的“锈皮”,水桶底下还沉积有少量泥沙似的杂质。此后,他天天观察,原来这个现象天天都存在。经过分析他提出了一个假设, 并取样回到学校实验室里进行了验证,证实了自己的假设。请你推测井水中可能含有较多的金属离子是___________,你认为该同学可以用什么方案验证所提出的假设______________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波市高三第二次模拟考试理综化学试卷(解析版) 题型:计算题
草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
|
实验 编号 |
A(KMnO4溶液浓度/mol·L-1) |
B(草酸溶液浓度/mol·L-1) |
C(硫酸溶液浓度/mol·L-1) |
褪色时间/s |
|
1 |
3 |
3 |
1 |
336 |
|
2 |
1 |
2 |
3 |
82 |
|
3 |
3 |
1 |
3 |
76 |
|
4 |
1 |
3 |
2 |
133 |
|
5 |
2 |
3 |
3 |
102 |
|
6 |
3 |
2 |
2 |
156 |
|
7 |
2 |
2 |
1 |
300 |
|
8 |
2 |
1 |
2 |
115 |
|
9 |
1 |
1 |
1 |
200 |
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
|
|
A(KMnO4溶液) |
B(草酸溶液) |
C(硫酸溶液) |
||||||
|
浓度/mol·L-1 |
0.005 |
0.010 |
0.015 |
0.1 |
0.5 |
0.9 |
6 |
12 |
18 |
|
平均褪色时间/s |
138.3 |
172.3 |
189.3 |
130.3 |
179.3 |
190.3 |
278.7 |
134.7 |
86.7 |
(2)由表2可知,三因素中, 的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而 的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为 mol·L-1、草酸浓度为 mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
|
c(H2SO4)/mol·L-1 |
18 |
16 |
14 |
12 |
10 |
8 |
6 |
|
褪色时间/s |
67 |
83 |
90 |
103 |
129 |
146 |
200 |
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为 mol·L-1和 mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com