
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
编号 物质(微粒) 电离度α
A 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- 10%
H++SO42- 10%
B 硫酸氢钠溶液: HSO4- H++SO42 29%
H++SO42 29%
C 醋酸: CH3COOH CH3COO-+H+ 1.33%
CH3COO-+H+ 1.33%
D 盐酸: HCl=H++Cl- 100%
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
科目:高中化学 来源: 题型:
| 已经电离的电解质分子数 |
| 溶液中原有电解质分子总数 |
| 10b-14 |
| a |
| 10b-14 |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 点解方程式 | 电离平衡常数 |
| CH3COOH | CH3COOH?CH3COO-+H+ | K=1.76×10-5 |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?HS-+H+ HS-?S2-+H+ |
K1=9.1×10-8 K2=1.1×10-15 |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| cα2 |
| 1-α |
| cα2 |
| 1-α |
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题

 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 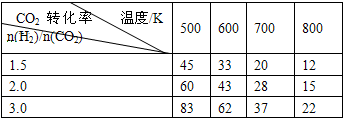

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
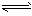 H++A-,则电离平衡常数
H++A-,则电离平衡常数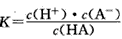 ,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。
,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。 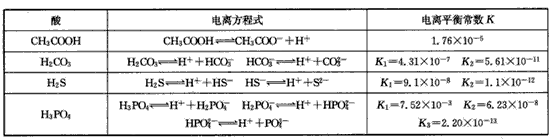
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:电离度可以表示弱电解质的电离程度,它表示已电离的弱电解质的物质的量占弱电解质总物质的量的百分数。在室温条件下:
(1)设某pH值的硫酸溶液中水的电离度为α1,相同pH值的硫酸铝溶液中水的电离度为α2,相比较α1 ______α2 (填<、>或=)。
(2)若硫酸和硫酸铝两种溶液的pH值都是3,那么硫酸中水电离出的c(H+)是硫酸铝溶液中水电离出的c(H+)的________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com