
【题目】单质X与浓H2SO4共热,反应中X与浓H2SO4的物质的量之比为1:2,则X元素在生成物中的化合价可能为 ①+l ②+2 ③+3 ④+4
A. ②④ B. ③④ C. ①② D. ①③
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
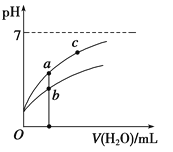
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课外学习小组为检验溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作。其中操作过程中产生的气体能使红色石蕊试纸变蓝,由该实验能得到的正确结论是( )
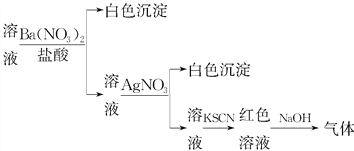
A. 溶液中一定含有SO![]()
B. 溶液中一定含有NH![]()
C. 溶液中一定含有Cl-
D. 溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预测原子序数为114的元素具有相当稳定的同位素,它的位置是在第七周期、第ⅣA族,称为“类铅”,关于它的性质的预测错误的是( )
A.它的原子最外层有4个电子
B.它具有+2、+4价
C.金属铜能从114号元素的硝酸盐溶液中置换出该元素的单质
D.它的金属性比铅强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.H2+CuO═Cu+H2O
B.2Na2O2+2H2O═4NaOH+O2↑
C.H2+Cl2═2HCl
D.2NaOH+Cl2═NaCl+NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
B. 在燃煤中加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2
C. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
D. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,pH = 12的NaOH溶液100 mL ,欲使它的pH降为11,需加入pH = 10的NaOH溶液___________ mL ;在25℃时,有pH为a的盐酸和pH为b的NaOH溶液等体积混合:若a+b=13,则溶液呈 性;pH为2的盐酸和pH为12的NaOH溶液,由水电离的氢离子浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%浓硫酸配制2mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是
A. 未冷却就转移、定容 B. 容量瓶原有少量蒸馏水
C. 定容时俯视刻度线观察液面 D. 量筒取浓盐酸时,俯视读数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com