
【题目】国家航天局计划2020年实施火星探测任务。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。
请回答下列问题:
(1)邻氨基吡啶(![]() )的铜配台物在有机不对称合成中起催化诱导效应。
)的铜配台物在有机不对称合成中起催化诱导效应。
①邻氨基吡啶中所有元素的电负性出小到大的顺序为__(填元素符号)。设NA为阿伏加德罗常数的值,1mol![]() 中含有σ键的数目为__。
中含有σ键的数目为__。
②一定条件下-NH2可以被氧化成-NO2,-NO2中N原子的杂化方式为__杂化。
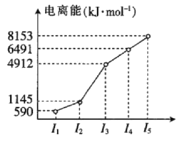
(2)第四周期的某主族元素,其第一至第五电离能数据如图所示,则该元素的基态原子电子排布式为___。
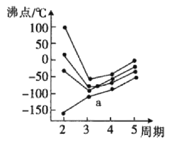
(3)元素周期表中的第IVA族~第VIIA族中部分元素的最简单氢化物的沸点变化趋势线如图,其中一个小黑点代表-种氢化物,则趋势线a代表第__族元素的最简单氢化物的沸点变化趋势,判断依据是__。
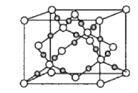
(4)干冰是常见的分子晶体,而CO2在高温高压下能形成另一种晶体其晶胞如图所示,该CO2晶体的熔点__(填“>”“<”或“=”)SiO2晶体的熔点。
(5)一种嘌呤和一种吡啶的结构如图。
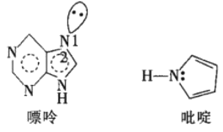
①嘌呤中轨道之间的夹角∠1比∠2大,原因是__。
②分子中的大π键可以用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡啶中的大π键可表示为__。
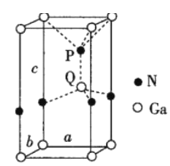
(6)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。若该晶体密度为dg·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=___nm(写出代数式)。
【答案】H<C<N 13NA sp2 1s22s22p63s23p64s2 IVA NH3、H2O、HF因存在氢键,沸点高于同主族相邻元素氢化物的,从而出现沸点反常现象,只有ⅣA族元素氢化物不存在反常现象,图中趋势线a没有反常现象 > 孤电子对与键合电子对之间的斥力大于键合电子对之间的斥力,斥力大 ![]()
![]()
【解析】
(1)①非金属性越强电负性越大;![]() 分子环上还有4个C-H将,分子含有13个σ键;
分子环上还有4个C-H将,分子含有13个σ键;
②-NO2中N原子有1个未成键电子,价层电子对数=2+1=3;
(2)根据图中该元素的第一至五电离能数据可知,该元素第三电离能突变,说明该元素容易失去2个电子,即最外层有两个电子,则为第IIA族元素Ca;
(3)含有氢键的氢化物熔沸点较高,不含氢键的氢化物熔沸点随着分子间作用力增大而增大;
(4)根据图知,CO2在高温高压下所形成的晶体为原子晶体,原子晶体熔沸点与原子半径成反比;
(5)①根据VSEPR理论,孤电子对与键合电子对之间的斥力大于键合电子对与键合电子对之间的斥力,导致键合电子对与对键合电子对之间的夹角减小;
②吡啶为平面结构,N形成3个共价键,未参与成键的p轨道有一对电子,参与形成离域大π键,每个C原子留有一个p轨道,轨道上留有一个单电子形成大π键;
(6)均摊法计算晶胞中Ga、N原子数目,表示出晶胞的质量,晶胞体积=a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm,结合晶胞质量=晶体密度×晶胞体积计算。
(1)①非金属性越强电负性越大,故电负性:H<C<N;![]() 分子环上还有4个C-H将,分子含有13个σ键,1mol
分子环上还有4个C-H将,分子含有13个σ键,1mol![]() 中含有σ键的数目为13NA,故答案为:H<C<N;13NA;
中含有σ键的数目为13NA,故答案为:H<C<N;13NA;
②-NO2中N原子有1个未成键电子,价层电子对数=2+1=3,N原子采取sp2杂化,故答案为:sp2;
(2)由该元素的第一至五电离能数据可知,该元素第一二电离能较小,说明容易失去2个电子,即最外层有两个电子,已知该元素为第四周期的某主族元素,则为第四周期,第IIA族元素Ca,则该元素的基态原子电子排布式为:1s22s22p63s23p64s2,故答案为:1s22s22p63s23p64s2;
(3)在ⅣA~ⅦA中的氢化物里,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,组成与结构相似,相对分子量越大,分子间作用力越大,沸点越高,故曲线a点代表的应是第IVA的氢化物沸点变化,
故答案为:IVA;NH3、H2O、HF因存在氢键,沸点高于同主族相邻元素氢化物的,从而出现沸点反常现象,只有ⅣA族元素氢化物不存在反常现象,图中趋势线a没有反常现象;
(4)该晶体中原子之间通过共价键结合,属于原子晶体,而碳氧键的键长短,所以该晶体的熔点比SiO2晶体高,故答案为:>;
(5)①根据VSEPR理论,孤电子对对键合电子对之间的斥力大于键合电子对对键合电子对之间的斥力,导致键合电子对对键合电子对之间的夹角减小,故答案为:孤电子对与键合电子对之间的斥力大于键合电子对之间的斥力,斥力大;
②吡啶为平面结构,N形成3个共价键,未参与成键的p轨道有一对电子,参与形成离域大π键,每个C原子留有一个p轨道,轨道上留有一个单电子形成大π键,所以吡啶环形成5中心6电子的离域大π键:![]() ,故答案为:
,故答案为:![]() ;
;
(6)晶胞中Ga原子数目=1+8×![]() =2、N原子数目=1+4×
=2、N原子数目=1+4×![]() =2,故晶胞质量=2×
=2,故晶胞质量=2×![]() g,晶胞体积=a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm,则:2×
g,晶胞体积=a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm,则:2×![]() g=(a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm)×dgcm3,解得c=
g=(a×10-7 cm×b×10-7 cm×sin60°×c×10-7 cm)×dgcm3,解得c=![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl36H2O能否反应产生Cl2。
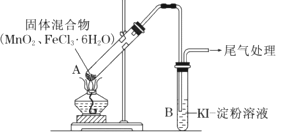
资料:FeCl3是一种共价化合物,熔点306℃,沸点315℃。
ⅰ.实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
ⅱ.分析现象的成因:
(1)现象i中的白雾是______,用化学方程式和必要的文字说明白雾的形成原因是______。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液,溶液均变红。通过该实验说明现象ii中黄色气体含有______。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
可能原因①:实验b检出的气体使之变蓝;
反应的离子方程式是______。
可能原因②:______;
反应的离子方程式是______。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
方案2 | 将B中KI-淀粉溶液替换为NaBr溶液;检验Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
①方案1的C中盛放的试剂是______,从化学平衡原理的角度加以解释______。
②方案2中检验Fe2+的最佳试剂是______,若存在Fe2+,则现象是______。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据是______。
(5)将A中产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氢氧燃料电池的原理如图所示。该电池的负极反应式为:H2-2e-![]() 2H+。则下列判断中错误的是( )
2H+。则下列判断中错误的是( )

A.a处通入的是H2
B.电解质溶液可能是NaOH溶液
C.电极X是负极,被氧化
D.Y极的反应为O2+4e-+4H+![]() 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(气)+3B(气)![]() 2C(气)+2D(固)达到平衡的标志的是
2C(气)+2D(固)达到平衡的标志的是
①C的生成速率与C的分解速率相等 ②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化 ④恒容下,混合气体的密度不再变化
⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB ⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧ C.①③④⑦ D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产电池、涂料以及感光材料的原材料。为探究纯净草酸亚铁晶体热分解的产物,设计装置图如下:
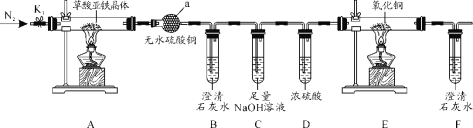
(1)仪器a的名称是______。
(2)从绿色化学考虑,该套装置存在的明显缺陷是_________。
(3)实验前先通入一段时间N2,其目的为__________。
(4)实验证明了气体产物中含有CO,依据的实验现象为_______。
(5)草酸亚铁晶体在空气易被氧化,检验草酸亚铁晶体是否氧化变质的实验操作是____。
(6)称取5.40g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如下图所示:

①上图中M点对应物质的化学式为_________。
②已知400℃时,剩余固体是铁的一种氧化物,试通过计算写出M→N发生反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:

下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△HD.生成NH3:2LiNH+3H2═2LiH+2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):

已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
② (-NH2容易被氧化);
(-NH2容易被氧化);
③ R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)C![]() D的反应类型是______,I的结构简式为______。
D的反应类型是______,I的结构简式为______。
(3)F![]() G的化学方程式为______。
G的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物乙苯(![]() )的说法正确的是
)的说法正确的是
A.沸点比苯高
B.分子中所有碳原子不可能共平面
C.二氯代物共有12种
D.能与H2发生加成反应,说明分子中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,并制备硫酸。设计装置如图所示(已知电极为石墨电极只起导电作用,交换膜分别是只允许阴阳离子通过的阴阳离子交换膜)。下列叙述中错误的是
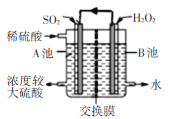
A.该交换膜为阳离子交换膜
B.若11.2 L(标准状况)SO2参与反应,则A池中增加2 mol H+
C.B池中的反应为H2O2+2e-+2H+=2H2O
D.导线上箭头方向表示电流方向
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com