
����Ŀ��I�������仯�����������������ϵ���С�
(1)��ͼ��ʵ�����о���ˮ����բ��ͬ��λ��ʴ���������ʾ��ͼ.

���õ绯��ʴ��Ϊ___________��
��ͼ��A��B��C��D�ĸ�������������������___________ (����ĸ)��
(2)��֪��Fe(s)+O2(g)=FeO(s)H=-272.0kJmol-1
C(s)+O2(g)=CO2(g)����H=-393.5kJmol-1
2C(s)+O2(g)=2CO(g)����H=-221kJmol-1
���¯����������FeO(s)+CO![]() Fe(S)+CO2(g) ��H=____________��
Fe(S)+CO2(g) ��H=____________��
II���״���һ����Ҫ�Ļ���ԭ�Ϻ�����ȼ�ϡ���ͼ�Ǽ״�ȼ�ϵ�ع�����ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��


(1)���и����ĵ缫��ӦʽΪ_________________��
(2)����A�������������ڱ�״���µ����Ϊ_____________��
(3)��װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ��ͼ����ͼ�����߱�ʾ����_____________���ӵı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ_________________mL 5��0 molL-1 NaOH��Һ��
���𰸡�
I.(1)��������ʴ����B��(2)-11KJ��mol-1��
II.��CH3OH�D6e-��8OH-=CO32-��6H2O����2.24L����Fe2����280��
��������
���������I.(1)����ˮ��Һ���ǽ�ǿ������Һ�����������������ʴ���ʴ�Ϊ��������ʴ���������Ӵ�������ˮʱ������������ʴ�ij̶��������������࣬����B����������࣬�ʴ�Ϊ��B��
(2)��֪����Fe(s)+![]() O2(g)�TFeO(s)��H=-272kJmol-1��
O2(g)�TFeO(s)��H=-272kJmol-1��
��C(s)+O2(g)�TCO2(g)��H=-393.5kJmol-1��
��2C(s)+O2(g)�T2CO(g)��H=-221kJmol-1��
���ݸ�˹���ɣ���-�ۡ�![]() -���ɵã�
-���ɵã�
FeO(s)+CO(g)=Fe(s)+CO2(g)����
��H=-393.5kJmol-1-![]() ��(-221kJmol-1)-(-272kJmol-1)=-11kJmol-1���ʴ�Ϊ��-11 kJmol-1��
��(-221kJmol-1)-(-272kJmol-1)=-11kJmol-1���ʴ�Ϊ��-11 kJmol-1��
����(1)�״�ȼ�ϵ����ԭ��ط�Ӧ���״��ڸ���ʧ���ӷ���������Ӧ���缫��ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O���ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
(2)����һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ�������缫��Ӧ��BΪ��������Һ��ͭ���������������ӵõ����������������������������ʵ���ΪX����Һ��ͭ�������ʵ���Ϊ0.1mol���缫��ӦΪ��
Cu2++2e-=Cu��
0.1mol 0.2mol
2H++2e-=H2����
2x x
A�缫Ϊ��������Һ�е�����������ʧ���������������缫��ӦΪ��
4OH--4e-=2H2O+O2����
4x x
���ݵ�ʧ�����غ�õ�0.2+2x=4x��x=0.1mol������A�����������������������ʵ���Ϊ0.1mol���ڱ�״���µ����Ϊ2.24L���ʴ�Ϊ��2.24L��
(3)����ת�Ƶ��ӵ����ʵ����ͽ��������ӵ����ʵ����ı仯����֪��ͭ���Ӵ������࣬���������ʵ�����С�������������ӣ�����ΪFe3+����ΪFe2+����ΪCu2+����ͼ��֪����ת��Ϊ0.4mol������Cu2+���ʵ���Ϊ0.2mol�������缫��ӦFe3++e-=Fe2+����Ӧ��������Һ����Fe2+Ϊ0.5mol��Cu2+Ϊ0.2mol��������Ҫ����NaOH��Һ0.5��2+0.2��2=1.4mol����������NaOH��Һ�����Ϊ![]() =0.28L=280mL���ʴ�Ϊ��Fe2+��280��
=0.28L=280mL���ʴ�Ϊ��Fe2+��280��


 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�Ⱦ�Ϊ0.10 mol/L�������ΪV0��MOH��ROH��Һ���ֱ��ˮϡ�������V��pH��![]() �ı仯��ͼ��ʾ������������������( )
�ı仯��ͼ��ʾ������������������( )

A��MOH�ļ���ǿ��ROH�ļ���
B��ROH�ĵ���̶ȣ�b�����a��
C��������Һ����ϡ�ͣ������ǵ�c(OH-)���
D����lg![]() =2ʱ��������Һͬʱ�����¶ȣ���
=2ʱ��������Һͬʱ�����¶ȣ��� ![]() ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��105 Pa��298 Kʱ����1 mol��̬AB���ӷ������̬Aԭ�Ӻ�Bԭ������Ҫ��������Ϊ����(kJ��mol��1)��������һЩ���ۼ��ļ��ܣ�(��֪���������������ȼ۵ĵ���ۼ�)
���ۼ� | H-H�� | N��N�� | N-H�� |
����(kJ��mol��1) | 436 | 945 | 391 |
��ҵ�ϳɰ��Ļ�ѧ����ʽ��N2��3H2![]() 2NH3��
2NH3��
�Ͽ�1 mol N2�еĻ�ѧ����_____ (����ա��ų���)945 kJ�������γ�2 mol NH3�еĻ�ѧ����_____ (����ա��ų���) ________ kJ������
��298 Kʱ��ȡ1 mol N2��3 mol H2����һ�ܱ������У��ڴ��������½��з�Ӧ�������Ϸų������յ�����ΪQ1����Q1Ϊ____________ kJ��
�����ϱ��е������жϹ�ҵ�ϳɰ��ķ�Ӧ��______(����ȡ����ȡ�)��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ֲ��֦Ҷ��ȡ�ľ����к��мס������ֳɷ֣�
![]()
![]()
��1���������Ը��������Һ��������к���̼̼˫���������Ƿ���� ����С������С�����
����д����һ����ͬʱ��������3��������ͬ���칹��Ľṹ��ʽ ��
a����������������ͬ��ȡ����
b������Br2��CCl4��Һ�����ӳɷ�Ӧ
c����FeCl3��Һ������ɫ
��2���ɼ�ת��Ϊ�ҵĹ���Ϊ(����ȥ�ز���)��

�������ķ�Ӧ����Ϊ ��Y�Ľṹ��ʽ ����Ʋ�������Ŀ���� ��
��3��1 mol�������� mol H2�����ӳɷ�Ӧ��
��4��д����������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������У������ý�������ṹ���Խ��͵���
A. ���� B. ���� C. ����չ�� D. ����ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��Դ�Ĺ���ԭ����ͼ������˵������ȷ����( )
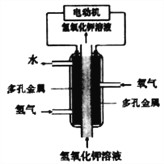
A. ���ö�������缫������缫�Ӵ��������߶��������������
B. ͨH2�ĵ缫������������������Ӧ
C. ͨO2�ĵ缫�����ĵ缫��Ӧ��O2+4e-+4H+=2H2O
D. �õ�ع���ʱ��������Ҫ����ת����ʽΪ��ѧ��ת��Ϊ���ܺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1000mol��L-1NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬѡ�÷�̪Ϊָʾ������ɲⶨ���ƫ�ߵ�ԭ�������
A��ʢװ����Һ����ƿ������ˮϴ����û�ô���Һ��ϴ
B����ʽ�ζ�����ʹ��ǰδ�ô���Һ������ϴ
C���ζ�ǰ��ʽ�ζ��ܼ����������ݣ��ζ���������ʧ
D���ζ�ǰ����ƽ�ӣ��ζ��յ����ʱ���Ӽ�ʽ�ζ��ܵĿ̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��л���ṹ�������������
A. �����������Ļ�������ڹ��������ɵ��л����������ͬ���칹��
B. ���ΪC7H16�������н�����һ�ֵ�ϩ��������Ƶõ���2��
C. ij���Ľṹ��ʽ�ɱ�ʾΪ![]() ��̼ԭ������10)����֪�����������ֻ�ѧ������ͬ����ԭ�ӣ�����Ŀ֮��Ϊ3��2�������һ���DZ���ͬϵ��
��̼ԭ������10)����֪�����������ֻ�ѧ������ͬ����ԭ�ӣ�����Ŀ֮��Ϊ3��2�������һ���DZ���ͬϵ��
D. ��5��̼ԭ�ӵ��л��ÿ�������������γ�4��C��C��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ���Ϊ500ml��I��II��III�����ܱ������зֱ����l molN2��2.5 molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䣬������������ͬ������·�����ӦN2(g)��3H2(g) ![]() 2NH3(��H<0)��ʵ���÷�Ӧ�����е�t minʱN2�����������ͼ��ʾ������˵����ȷ����
2NH3(��H<0)��ʵ���÷�Ӧ�����е�t minʱN2�����������ͼ��ʾ������˵����ȷ����

A����v(H2)=3v(N2)ʱ������˵�����������еķ�Ӧ��ƽ��״̬
B����t minʱ��һ���ﻯѧƽ��״̬����������
C����t minʱ�����c(N2)=1mol/L��������III�г���1.5molN2��1molNH3��H2��ת���ʲ���
D�����������еķ�Ӧ���ﵽƽ�������I�л�������ƽ����Է���������С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com