
(每空2分,共14分)(1)483g Na2SO4·10H2O中所含的Na+的物质的量是 和SO42—的物质的量是 ,所含H2O分子的数目是 个。
(2)同温同压下,同体积的氨气(NH3)和氧气的质量比是__________,相同质量的氨气和氧气的体积比是________;
(3)同温同压下同体积的H2和A气体的质量分别是0.2 g和1.6 g,则气体A的相对分子质量为________,含有A的分子个数为________。
21. (1)3mol 1.5mol 15NA (2)17:32 32:17 (3)16 6.02×1022
【解析】
试题分析:(1)根据n=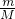 =
=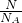 结合物质的组成计算相关物理量并且摩尔质量在数值上等于相对分子质量,M(Na2SO4?10H2O)=322g/mol,n(Na2SO4?10H2O)=
结合物质的组成计算相关物理量并且摩尔质量在数值上等于相对分子质量,M(Na2SO4?10H2O)=322g/mol,n(Na2SO4?10H2O)=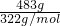 =1.5mol,n(Na+)=2n(Na2SO4?10H2O)=2×1.5mol=3mol,n(SO42-)=n(Na2SO4?10H2O)=1.5mol,n(H2O)=10n(Na2SO4?10H2O)=10×1.5mol=15mol,N(H2O)=15mol×NA个/mol=15NA(或9.03×1024),答案为:1.5mol;322g/mol;1.5mol;3mol;15NA(或9.03×1024)。(2)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故同温同压下,同体积的氨气(NH3)和氧气的质量比为17g/mol:32g/mol=17:32,同温同压下,同质量的气体的体积之比与摩尔质量成反比,故同温同压下,相同质量的氨气和氧气的体积比为32g/mol:17g/mol=32:17,答案为:17:32,32:17;(3)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故0.2g:1.6g=2g/mol:M(A),解得M(A)=16g/mol,故A的相对分子质量为16,1.6gA的物质的量为
=1.5mol,n(Na+)=2n(Na2SO4?10H2O)=2×1.5mol=3mol,n(SO42-)=n(Na2SO4?10H2O)=1.5mol,n(H2O)=10n(Na2SO4?10H2O)=10×1.5mol=15mol,N(H2O)=15mol×NA个/mol=15NA(或9.03×1024),答案为:1.5mol;322g/mol;1.5mol;3mol;15NA(或9.03×1024)。(2)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故同温同压下,同体积的氨气(NH3)和氧气的质量比为17g/mol:32g/mol=17:32,同温同压下,同质量的气体的体积之比与摩尔质量成反比,故同温同压下,相同质量的氨气和氧气的体积比为32g/mol:17g/mol=32:17,答案为:17:32,32:17;(3)同温同压下,同体积的气体,质量之比等于摩尔质量之比,故0.2g:1.6g=2g/mol:M(A),解得M(A)=16g/mol,故A的相对分子质量为16,1.6gA的物质的量为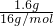 =0.1mol,A的分子数目为0.1mol×NAmol-1=0.1NA,答案为:16,0.1NA或6.02×1022。
=0.1mol,A的分子数目为0.1mol×NAmol-1=0.1NA,答案为:16,0.1NA或6.02×1022。
考点:考查物质的量的相关计算。


科目:高中化学 来源:2014-2015学年甘肃省高二第一学期期中考试化学试卷(解析版) 题型:选择题
在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①②③ B.①②③⑤ C.②⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高一上学期期中考试化学试卷(解析版) 题型:选择题
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
A、1:1 B、 1:4 C、4:1 D、1:2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高一上学期期中考试化学试卷(解析版) 题型:选择题
用如图所示的方法研究某气体的性质,这种方法属于( )

A.实验法 B.观察法 C.分类法 D.比较法
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高一上学期期中考试化学试卷(解析版) 题型:选择题
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面所列物质,贴错了包装标签的是( )
选项 | A | B | C | D |
物质 | 浓硫酸 | 汽油 | 酒精 | 氯酸钾 |
标签 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,相关说法不正确的是( )
A.13.5 g Al与足量盐酸反应生成H2的分子数为NA
B.标准状况下,2.24 L CH4所含电子数为NA
C.500 mL 1 mol·L-1的K2SO4溶液中含有K+数目为NA
D.0.5 mol O2和0.5 mol O3的混合物所含有的氧原子个数为2.5NAA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl-
B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+
D.某溶液加稀硫酸生成白色沉淀,说明原溶液中有Ba2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
.已知:①2C(s)+O2(g)====2CO(g) ΔH=-221.0 kJ·mol-1;②2H2(g)+O2(g) ====2H2O(g) ΔH=-483.6 kJ·mol-1。则反应C(s)+H2O(g) ====CO(g)+H2(g)的ΔH为( )
A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1 D.+131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:填空题
(1) 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: _ 。
若1g水蒸气转化成液态水放热2.444kJ,则氢气的燃烧热为_____________。
(2)已知① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/mol
② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/mol
③C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/mol
试写出一氧化碳与氢气反应生成液态水和乙醇液体的热化学方程式:
___________________________________________________________。
(3)Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K,测得在不同
温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
①若500℃时进行反应,CO2起始浓度为2 mol·L-1,CO的平衡浓度为________。
②此反应焓变中的a________0(填大于、小于、等于)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com