
常温下,下列溶液中各组离子一定大量共存的是
A.使甲基橙呈红色的溶液中:Na+、AlO2—、NO3—、CO32—
B.c(ClO-)=1.0 mol·L-1溶液:Na+、SO32-、S2-、Cl-
C.含有0.1 mol·L-1 的溶液:Na+、Fe3+、
的溶液:Na+、Fe3+、 、SCN-
、SCN-
D. =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3—
=0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3—
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为7.84L;另一份在高温下恰好完全反应,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A.5.6L B.7.84L C.11.2L D.15.68L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:填空题
(16分)某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,
则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。 假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红溶液。
L-1KSCN溶液、品红溶液。
实验步骤 | 预期现象和结论 |
步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立; (2)若未出现血红色,则假设2或假设3成立。 |
步骤2: |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(7分)现有部分元素的原子结构特点如下表:
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(1)画出W原子结构示意图:_____ _______。
(2)元素X与元素Z相比,非金属性较强的是__ ____(填元素符号),写出一个能表示X、Z非金属性强弱关系的化学反应方程式:___________ _________________。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为_______ _。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:______ _________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
元素周期律揭示了元素间的递变规律,下列递变规律正确的是
A.第二周期元素氢化物稳定性:HF>H2O, 所以第三周期元素氢化物稳定性:HCl>H2S
B.ⅣA族元素氢化物沸点:SiH4 > CH4,所以ⅤA族元素氢化物沸点:PH3 > NH3
C.ⅦA族元素的非金属性:F>Cl, 所以ⅦA族元素氢化物的酸性:HF>HCl
D.镁比铝活泼,工业上用电解熔融氧化铝,所以工业上也是电解熔融氧化镁制镁
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列表示物质结构的化学用语或模型正确的是
A.8个中子的碳原子的核素符号:12C
B.HF的电子式:
C.Cl-离子的结构示意图:
D.CH4分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(14分)A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。
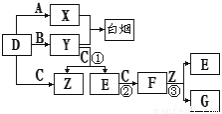
请回答下列问题:
(1)D的化学式为 。
(2)写出实验室制Y的化学方程式 。
(3)反应③的离子方程式为 。
(4)写出反应①的化学方程式 。
(5)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(6)常温下0.1 mol·L-1的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1 mol·L-1
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D.pH=3的盐酸溶液V1 L与该0.1 mol·L-1的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将以上溶液加水稀释100倍后,pH为9
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组物质中均能造成大气污染的是
A.H2S、SO2、粉尘、煤烟、氮的氧化物、碳氢化合物
B.N2、NO2、粉尘、煤烟
C.CO2、O2、氮的氧化物、碳氢化合物
D.Cl2、N2、煤烟、氮的氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
已知常温下,AgBr的Ksp=4.9×10-13 mol2·L-2、AgI的Ksp=8.3×10-17 mol2·L-2 下列说法正确的是:
A.常温下AgI水溶液中,Ag+和I-浓度的乘积是一个常数
B.常温下,在任何含AgI固体的溶液中,c(Ag+)=c(I-)且Ag+与I-浓度的乘积等于8.3×10-17mol2·L-2
C.常温下,将1mL 1.0×10-2 mol/L的KI与AgNO3溶液等体积混合,则生成AgI沉淀所需AgNO3溶液的最小浓度为3.32×10-14 mol/L
D.向AgI饱和溶液中加入AgBr固体,c(I-)不变,Ksp值不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com