
将17.9 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36 L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72 L NO(标准状况),向反应后的溶液中加人过量NaOH溶液,得到沉淀的质量为
A.33.2 g B.25.4 g C.22.4 g D.19.6 g
 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源:2015-2016学年辽宁大连经济技术开发区得胜高中高二下期中化学试卷(解析版) 题型:选择题
下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
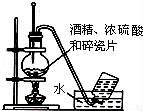
A.实验室用乙醇制取乙烯
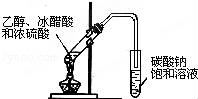
B.实验室制取乙酸乙酯
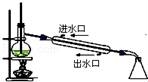
C.石油分馏

D.实验室制取硝基苯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省国科园实验学校高二下期中化学试卷(解析版) 题型:选择题
①加热;
②加入蒸馏水;
③加入硝酸银溶液;
④加入氢氧化钠溶液;
⑤加入氢氧化钠的醇溶液;
⑥加入硝酸溶液.
A. ④①⑥③ B. ②①③⑥ C. ⑤①③⑥ D. ①④③⑥
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三7月暑期摸底检测化学试卷(解析版) 题型:选择题
下列实验操作对实验结果不产生影响的是
A.用酸碱中和滴定法测定未知浓度的碱液时,加入甲基橙或酚酞1~2 mL
B.用托盘天平称量4.2 g NaCl时,左盘放砝码,右盘放NaCl
C.用pH试纸测定90 ℃时纯水的pH
D.配制一定物质的量浓度的溶液时,容量瓶用蒸馏水洗净后未干燥
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:实验题
SnSO4是一种重要的硫酸盐,在工业生产中有着广泛的应用。其制备路线如下:
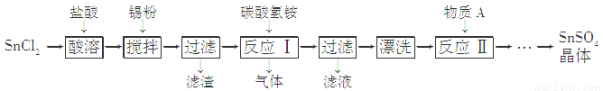
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡 Sn(OH)Cl]。
(1) 写出物质A的名称:___ _____。
(2) SnCl2用盐酸而不用水溶解的原因是__________ __________(用化学方程式表示)。
(3) 锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:
_______________ _______________。
(4) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式:_ _ __。该反应的温度需要控制在75 ℃左右的原因是_ _ _ _。
(5) 实验室中“漂洗”沉淀的实验操作方法是_ _ __。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
对实验Ⅰ~Ⅳ的实验现象预测正确的是
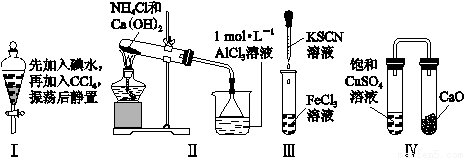
A. 实验Ⅰ:液体分层,下层呈无色
B. 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C. 实验Ⅲ:试管中立刻出现红色沉淀
D. 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述一定正确的是
A.标准状况下,5.6L SO3含有的分子数为0.25NA
B.标况下,0.1mol苯中含有C=C键数目为0.3NA
C.46g NO2和N2O4的混合气体中含有的原子个数为3NA
D.7.8g过氧化钠与足量CO2反应,转移电子数为0.2NA,CO2为还原剂
查看答案和解析>>
科目:高中化学 来源:2016届天津市高三下学期第五次月考化学试卷(解析版) 题型:选择题
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
B.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+)
C.将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH-)=2c(H+)+c(HA)-c(A-)
D.某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二下第一次月考化学试卷(解析版) 题型:选择题
已知次氯酸分子的结构式为H﹣O﹣Cl,下列有关说法正确的是( )
A.该分子的电子式是H:O:Cl
B.O原子与H、Cl都形成σ键
C.该分子为直线型分子
D.O原子发生sp杂化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com