
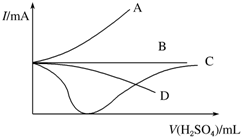
 (1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组
(1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-,按可能大量共存于同一溶液的情况,则分成A、B两组,而且每组中均含两种阳离子和两种阴离子,则A组

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阳极 |
| C、放电时负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、充电时每生成1 mol CH3OH转移12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
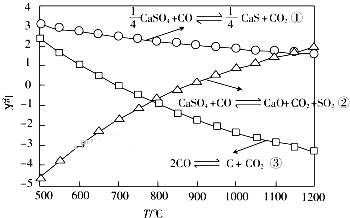 一氧化碳在高温下可还原硫酸钙,相关反应的平衡常数的对数与反应温度的关系如图所示.
一氧化碳在高温下可还原硫酸钙,相关反应的平衡常数的对数与反应温度的关系如图所示.| 1 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中有Fe2+、Cu2+ |
| B、剩下的固体是Fe和Cu |
| C、溶液中有Fe3+、Fe2+ |
| D、剩下的固体是Fe,无Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当溶液中Al3+全部沉淀出来时,沉淀的总物质的量最大 |
| B、当溶液中Al3+全部沉淀出来时,沉淀的总质量最大 |
| C、先生成沉淀,后沉淀全部溶解 |
| D、最后的沉淀为2mol BaSO4、1mol Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和的碳酸钠溶液中通入CO2气体,没有明显实验现象 |
| B、向久置于空气中的FeSO4溶液中滴加NaOH溶液,产生大量白色沉淀 |
| C、在空气中用酒精灯加热铝箔,铝箔熔化,失去光泽,但熔化的铝并不滴落 |
| D、向某溶液中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明该溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸加入氨水:CH3COOH+NH3?H2O=CH3COO-+NH4++H2O |
| B、铜片插入硝酸银溶液:Cu+Ag+=Cu 2++Ag |
| C、碳酸钙加入醋酸:CO32-+2 CH3COOH=CO2↑+2 CH3COO-+H2O |
| D、澄清的石灰水跟盐酸反应:H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com