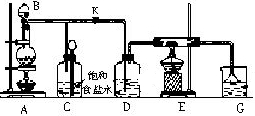
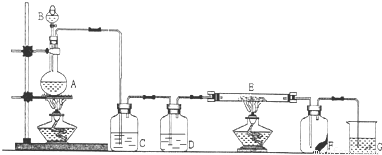
如图是实验室制取氯气并验证其性质的装置.C中装有饱和NaCl溶液,目的是除去氯气中的氯化氢杂质气体,E是中间装有铁丝网的硬质玻璃管.F是一张滴有KSCN和FeCl
2混合溶液的滤纸.
试回答:
(1)仪器B的名称为
分液漏斗
分液漏斗
;
(2)若用MnO
2与浓盐酸共热制取Cl
2,请写出相应的离子方程式
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
MnO
2+4H
++2Cl
-Mn
2++Cl
2↑+2H
2O
;
(3)D的作用是
干燥Cl2
干燥Cl2
.
(4)E中化学反应方程式为
;
(5)请根据G的作用,写出G中的离子反应方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
;
(6)若F中滤纸变红,用离子反应方程式表示变红的原因
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
、
Fe3++3SCN-=Fe(SCN)3;
Fe3++3SCN-=Fe(SCN)3;
;学生甲未见到滤纸变红,他认为原因是Cl
2将KSCN氧化了,乙认为是Cl
2将铁元素氧化,生成了一种特殊的无色物质.请你设计一个实验方案以帮助甲、乙验证自己的假设
取少许褪色后的溶液于试管中,加入KSCN溶液,如果溶液由无色变红色,则甲假设合理;如果不变色,则乙假设合理
取少许褪色后的溶液于试管中,加入KSCN溶液,如果溶液由无色变红色,则甲假设合理;如果不变色,则乙假设合理
.