
下图只表示出与反应有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请写出下列空白。

(1)化合物W的化学式可能是 或 ,C的电子式 ,F的颜色 。
(2)反应③的离子方程式为 。
(3)反应②中氧化剂和还原剂的物质的量之比为 。
(4)写出A→E的化学方程式 。
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016-2017学年河北省高二8月月考化学试卷(解析版) 题型:选择题
化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
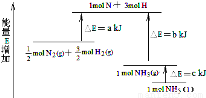
A.N2(g)+3H2(g)=2NH3(l);△H=2(a﹣b﹣c)kJ•mol﹣1
B.N2(g)+3H2(g)=2NH3(g);△H=2(b﹣a)kJ•mol﹣1
C.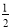 N2(g)+
N2(g)+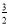 H2(g)=NH3(l);△H=(b+c﹣a)kJ•mol﹣1
H2(g)=NH3(l);△H=(b+c﹣a)kJ•mol﹣1
D.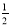 N2(g)+
N2(g)+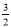 H2(g)=NH3(g);△H=(a+b)kJ•mol﹣1
H2(g)=NH3(g);△H=(a+b)kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高一上开学考化学卷(解析版) 题型:实验题
开学前某同学去实验室打扫卫生发现,放假前做实验用的氢氧化钠溶液忘记了盖瓶盖。对于该溶液是否变质,几位同学提出了自己的假设并展开了探究活动。

【猜想与假设】小松同学猜想:该溶液没有变质;小雷同学猜想:该溶液已变质
【表达与交流】小雷同学猜想的理由是(1)_____________________。
【实验验证】小松同学为了验正自己的猜想,取一定量试剂瓶中的液体于试管中,加入了少量的无色酚酞溶液,观察到溶液变成红色,于是认为自己的猪想正确。请对小松同学的结论做出评价(2)_______________。
小雷同学验证自己的猜想,取少量试剂瓶中的液体于试管中,加入了足量的稀盐酸,观察到溶液中有气泡产生,证实了溶液己经变质的猜想,写出有气泡产生的反应的化学方程式(3)_________________。
【验证与结论】小林同学和小文同学对已经变质的氢氧化钠溶液做了进一步探究,两位同学为了节约药品,将小松同学实验后的红色溶液平均分成两份于两只试管中,小林同学向其中一只试管中逐滴加入氢氧化钙溶液,观察到有白色沉淀生成,继续滴加至刚好不再产生沉淀时,发现溶液仍为红色,小林同学得出了该瓶溶液为部分变质的结论。请对小林同学的结论做出评价(4)______________________。
【反思与结论】小文同学向另一支试管中加入过量的一种溶液,观察到白色沉淀且溶液由红色变成了无色,准确证实了该瓶溶液已全部变质。请写出一种符合小文同学所加溶液的溶质的化学式(5)________。通过上述实验得出结论:在检验溶液中组成的实验操作中应注意的问题是(6)_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷(解析版) 题型:选择题
下表是元素周期表的一部分。五种元素均位于短周期,X、W的质子数之和为23。下列说法正确的是
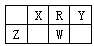
A. Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
B. W和R只能形成一种化合物WR3,且为酸性氧化物
C. X的最高价含氧酸与它的简单气态氢化物发生氧化还原反应
D. Z与R形成的化合物ZR2是生产光纤制品的基本原料
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷(解析版) 题型:选择题
A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A. 原子序数:A>B>C>D B. 单质熔点:D>B,A>C
C. 原子半径:C>B>D>A D. 简单离子半径:C>A>D>B
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上入学考试化学试卷(解析版) 题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=“a”kJ/mol
2Fe(s)+3CO2(g) △H=“a”kJ/mol
(1)己知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=“+”489.0kJ/mol
② C(石墨)+CO2(g)=2CO(g) △H2=“+”172.5kJ/mol
则a=______kJ/mol。
(2)冶炼铁反应的平衡常数表达式K=_______,温度升高后,K 值____(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
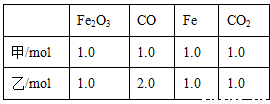
① 甲容器中CO 的平衡转化率为___________。
② 下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO 的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
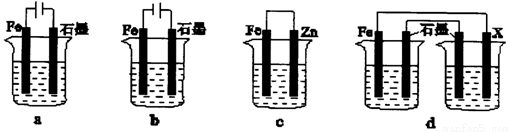
① 在a~c装置中,能保护铁的是________(填字母)。
② 若用d装置保护铁,X极的电极材料应是________(填名称)。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:选择题
中国稀土含量丰富,稀土元素用RE表示。在稀土元素提纯过程中可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀RE2(SO4)3·Na2SO4·xH2O析出,反应式RE2(SO4)3+Na2SO4+xH2O= RE2(SO4)3·Na2SO4·xH2O↓(x=1~2)。下列叙述正确的( )
A.反应生成的沉淀属于复盐 B.该反应一定在强碱溶液中进行
C.产生沉淀的反应为复分解反应 D.产生沉淀的变化属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com