
| A.932kJ | B.496kJ | C.738 kJ | D.248 kJ |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热才能发生的反应一定是吸热反应 |
| B.吸热反应在不加热的条件下一定不能发生 |
| C.吸热反应的反应物的总能量之和小于生成物的总能量之和 |
| D.某可逆反应,若正反应为吸热反应,逆反应也可能是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝跟盐酸反应 | B.Ba(OH)2 ·8H2O晶体与NH4CI晶体的反应 |
| C.盐酸与氢氧化钠溶液的反应 | D.酒精的燃烧 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 下列说法正确的是( )
下列说法正确的是( )| A.所有化学变化一定遵循质量守恒和能量守恒 |
| B.所有化学变化的能量都可以通过原电池转化为电能 |
| C.化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 |
| D.断开旧化学键与形成新化学键之间的能量差只能以热量的形式释放 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
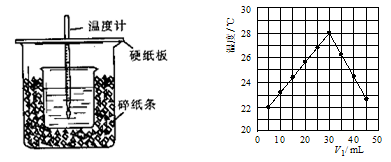
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学能 → 电能 | B.化学能 → 机械能 →电能 |
| C.化学能 → 热能 →电能 | D.化学能 → 热能 → 机械能 →电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com