
完成以下小题:
(1)已知NaHSO3溶液显酸性,则溶液中各离子浓度从大到小的顺序是________.
(2)25℃时,
向pH=4的NaHSO4溶液中,逐滴加入pH=9的Ba(OH)2溶液至中性,则该过程的离子反应方程式________;已知25℃时BaSO4的Ksp=1.0×10-10,则以上过程中________沉淀生成(填“有”或“无”).(3)某温度下,0.1 mol·L-1 Na2CO3溶液中c(Na+)∕c(CO![]() )=20/9,其原因是________;现往Na2CO3溶液中通入一定量的CO2后,c(Na+)∕c(CO
)=20/9,其原因是________;现往Na2CO3溶液中通入一定量的CO2后,c(Na+)∕c(CO![]() )=5∕2,其原因是________.(用离子方程式和必要的文字说明)
)=5∕2,其原因是________.(用离子方程式和必要的文字说明)
科目:高中化学 来源: 题型:
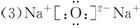
图1-3-7
请完成以下各题:
(1)若E是酸酐,B是单质,D是具有刺激性气味的无色气体,则B的化学式是____________,工业上实现D转化为E的化工设备的名称是______。
(2)若C是酸性气体,B是碱性气体,则E是______,在工业生产实际中,合成B时选择下列条件的依据是____________;
压强:20 MPa—50 MPa;温度:500℃
(3)若A是日常生活中最常见的物质,C为黄绿色气体单质,则D的电子式为______。
(4)若C是水,B是无氧化合物,且在同系物中是相对分子质量最小的化合物,E能使石蕊显红色,则A是______ (写化学式),A、B、D、E中易溶于水的是______(写化学式)。写出下列反应的化学方程式:
D![]() E:_________;B
E:_________;B![]() 高分子化合物:________。
高分子化合物:________。
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期第一学段考试化学试卷 题型:填空题
(9分)完成以下小题:
(1)已知NaHSO3溶液显酸性,则溶液中各离子浓度从大到小的顺序是 。
(2)25℃时,向pH=4的NaHSO4溶液中,逐滴加入pH=9的Ba(OH)2溶液至中性,则该过程的离子反应方程式 ;已知25℃时BaSO4的Ksp=1.0×10-10,则以上过程中 沉淀生成(填“有” 或“无”) 。
(3)某温度下,0.1 mol·L-1Na2CO3溶液中c(Na+)∕c(CO32-)=20/9,其原因是 ;现往Na2CO3溶液中通入一定量的CO2后,c(Na+)∕c(CO32-)=5∕2,其原因是 。(用离子方程式和必要的文字说明)
查看答案和解析>>
科目:高中化学 来源: 题型:
完成以下小题:
(1)请完成下列各空:
①pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
③0.1mol/LCH3COONa溶液的pH 7(填“>”或“<”);
(2)某固体是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3和(NH4)2SO4中的两种混合而成。取该固体溶于水得到无色澄清溶液,向该溶液中加入稀硫酸,有白色沉淀生成,继续加入稀硫酸,沉淀又完全消失,且整个过程中无气体产生。则 原固体中含有物质有 和 。(写化学式) K^S*5U.
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)完成以下小题:
(1)已知NaHSO3溶液显酸性,则溶液中各离子浓度从大到小的顺序是 。
(2)25℃时,向pH=4的NaHSO4溶液中,逐滴加入pH=9的Ba(OH)2溶液至中性,则该过程的离子反应方程式 ;已知25℃时BaSO4的Ksp=1.0×10-10,则以上过程中 沉淀生成(填“有” 或“无”) 。
(3)某温度下,0.1 mol·L-1Na2CO3溶液中c(Na+)∕c(CO32-)=20/9,其原因是 ;现往Na2CO3溶液中通入一定量的CO2后,c(Na+)∕c(CO32-)=5∕2,其原因是 。(用离子方程式和必要的文字说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com