
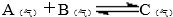 )前起始体积相同、且容积固定的容器中发生上述反应开始时放入1mol A和1mol B到达平衡后生成bmol C.将b与(1)小题中的a进行比较
)前起始体积相同、且容积固定的容器中发生上述反应开始时放入1mol A和1mol B到达平衡后生成bmol C.将b与(1)小题中的a进行比较

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
 实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:
实验室需要480mL 0.4mol?L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铅笔芯的主要成分是金属铅,儿童在使用是不可用嘴吮吸,以免引起铅中毒 |
| B、CO有毒,在生有炉火的居室中多放几盆水,可吸收CO,防止煤气中毒 |
| C、含氟冰箱产生的氟利昂是造成臭氧空洞的主要原因 |
| D、油条制作中常加入明矾作膨化剂,有利于补充身体所需微量元素,是理想早餐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L | B、2.8L |
| C、3.36L | D、4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该合金中铜与镁的物质的量之比是2:1 |
| B、得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
| C、NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D、该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃氢气前一定要检验氢气的纯度 |
| B、未使用完的白磷要随时收集起来,并与空气隔绝 |
| C、用氢气还原氧化铜时,要先通一会儿氢气,再加热氧化铜 |
| D、酒精灯不用时,必须盖上灯帽 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3和Al(OH)3 |
| B、BaCl2和NaCl |
| C、KClO3和K2SO4 |
| D、Na2SO3和BaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com