
【题目】强酸性溶液 X 中可能含有 Na+、K+、NH4+、Fe2+、Al3+、CO32-、SO32-、SO42-、Cl-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A. X中肯定存在Na+、Fe2+、A13+、NH4+、SO42―
B. 气体F在氧气中经催化氧化可生成气体A
C. 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3
D. X中不能确定的离子是 Fe2+、SO32-、K+和C1―
【答案】B
【解析】试题分析:强酸性溶液中CO32-、SO32-不能存在;则X溶液中加入过量Ba(NO3)2溶液生成沉淀C一定是BaSO4,一定有SO42-;硝酸被还原生成气体A,为NO,则一定有还原性的离子即Fe2+,溶液B加入过量NaOH溶液,生成气体,一定是氨气,则一定有NH4+,沉淀G为Fe(OH)3;溶液H通入CO2生成沉淀I,由于之前加入了过量的Ba(NO3)2溶液,引入了大量Ba2+,所以沉淀I中一定有BaCO3,不能确定溶液X中是否存在A13+,所以也不能确定沉淀I中是否有A1(OH)3;溶液J的焰色反应呈黄色,说明溶液J中有Na+,但由于之前加入了NaOH溶液,引入了Na+,所以不能确定溶液X中是否存在Na+;又因为黄色能掩盖紫色火焰,所以也不能确定溶液X中是否有K+;另外,是否存在C1-也不能确定,A、X中肯定存在Na+、Fe2+、NH4+、SO42-,不能确定Al3+是否存在,A错误;B、F是氨气、A是一氧化氮,根据4NH3+5O2![]() 4NO+6H2O,氨气能被氧化生成NO,B正确;C、沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I中一定有BaCO3,不能确定沉淀I中是否有A1(OH)3,C错误;D、X中不能确定的离子是Na+、Al3-、K+和C1-,D错误。答案选B。
4NO+6H2O,氨气能被氧化生成NO,B正确;C、沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I中一定有BaCO3,不能确定沉淀I中是否有A1(OH)3,C错误;D、X中不能确定的离子是Na+、Al3-、K+和C1-,D错误。答案选B。


科目:高中化学 来源: 题型:
【题目】有关碱金属元素,下列说法正确的是
A. 单质沸点随原子序数的递增而升高
B. 周期表第一列是第ⅠA 族元素,又称碱金属元素
C. 金属锂常用于制造锂电池,这跟它还原性强、密度小有关
D. 金属锂在空气中燃烧,产物是 Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列盐:① FeCl3 ② CH3COONa ③ NaCl,其水溶液的pH由大到小排列正确的是( )
A.①>③>②B.②>③>①C.③>②>①D.①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X,Y,Z三种非金属元素,A,B,C三种金属元素,有如下情况:
(i)X,Y,Z的单质在常温下均为气体.
(ii)X的单质在Z的单质中燃烧,火焰呈苍白色.产物XZ的水溶液可使石蕊试液变红.
(iii)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体.
(iv)Z的单质溶于X2Y中所得溶液具有漂白性.
(v)A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈黄色溶液.
(vi)B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解.
(vii)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色固体M.
请完成下列问题:
①写出下列物质的化学式:XZ , X2Y .
②Z的单质溶于X2Y中所得溶液中起漂白作用的物质是(填化学式)
③A的单质与Z的单质反应的化学方程式: .
④BZ3与过量的NaOH溶液反应的离子方程式: .
⑤X单质与Z单质的混合气体经点燃充分反应后,冷却至室温,再通入足量的NaOH溶液中,气体被完全吸收,求原混合气体中X单质与Z单质的体积比可能为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前我们手里把玩的许多新奇电子设备,都是由一些自然界含量稀少的稀有元素提供电能的。下列4种元素中,常用于手机电池的稀有金属元素是
A. 硫 B. 碲 C. 锂 D. 钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)![]() 2LiH(s) △H=-182kJ·mol-1;
2LiH(s) △H=-182kJ·mol-1;
②2H2(g)+O2(g)![]() 2H2O(1) △H=-572kJ·mol-1;
2H2O(1) △H=-572kJ·mol-1;
③4Li(s)+O2(g)![]() 2Li2O(s) △H=-1196kJ·mol-1。
2Li2O(s) △H=-1196kJ·mol-1。
则LiH在O2中燃烧的热化学方程式为( )
A. 2LiH(s)+O2(g)![]() Li2O(s)+H2O(1) △H=-702kJ·mol-1
Li2O(s)+H2O(1) △H=-702kJ·mol-1
B. 2LiH(s)+O2(g)![]() Li2O(s)+H2O(1) △H=-1950kJ·mol-1
Li2O(s)+H2O(1) △H=-1950kJ·mol-1
C. 2LiH(s)+O2(g)![]() Li2O(s)+H2O(1) △H=-1586kJ·mol-1
Li2O(s)+H2O(1) △H=-1586kJ·mol-1
D. 2LiH(s)+O2(g)![]() Li2O(s)+H2O(g) △H=-988kJ·mol-1
Li2O(s)+H2O(g) △H=-988kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中充入2 mol X和1 mol Y,发生反应2X(g)+Y(g)=2Z(g),当反应进行到4 min时,测得n(X) =0.4 mol。若反应进行到2 min时,容器中Y的物质的是( )
A. 小于 0. 6 mol B. 等于 1. 2 mol C. 等于 0.6 mol D. 小于 1. 2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式是______________________。
(2)降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)![]() N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
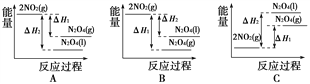
②N2O4与O2、H2O化合的化学方程式是___________________________________。
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com