
【题目】某化学反应2AB+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
实验 | 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为
(2)在实验1中,c1数值为
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验(选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3800(选填“<”或“>”).
【答案】
(1)0.02mol/(L?min)
(2)0.50
(3)2
(4)>
【解析】解:(1)反应在10~20分钟内用A表示的平均速率为v= ![]() =
= ![]() =0.02mol/(Lmin), 所以答案是:0.02mol/(Lmin); (2)实验2中,30min中便达到了化学平衡,平衡后,各组分浓度不随时间的改变而改变,所以c1=0.50 mol/L,所以答案是:0.50;(3)实验2中,反应经20min,A的浓度不再改变,说明达到平衡,较其它实验达到平衡时间最短,故使用了合适的催化剂,所以答案是:2;(4)温度越高化学反应速率越快,单位时间内A的平均速率为v1=0.02mol/(Lmin),v3=
=0.02mol/(Lmin), 所以答案是:0.02mol/(Lmin); (2)实验2中,30min中便达到了化学平衡,平衡后,各组分浓度不随时间的改变而改变,所以c1=0.50 mol/L,所以答案是:0.50;(3)实验2中,反应经20min,A的浓度不再改变,说明达到平衡,较其它实验达到平衡时间最短,故使用了合适的催化剂,所以答案是:2;(4)温度越高化学反应速率越快,单位时间内A的平均速率为v1=0.02mol/(Lmin),v3= ![]() =0.03mol/(Lmin),故实验三的速率快,即温度高,故T3>800,
=0.03mol/(Lmin),故实验三的速率快,即温度高,故T3>800,
所以答案是:>.


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素性质对比正确的是
A. 金属性:K>Na>Cs B. 稳定性:SiH4>H2S>HCl
C. 酸性:H2CO3>H2SiO3>HClO4 D. 非金属性:Cl>S>P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各问题:
(1)①泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其反应的离子方程式为:__________;
②TiCl4水解生成TiO2·xH2O的化学方程式__________;
③酸性高锰酸钾溶液与草酸溶液反应的化学方程式____________;
④硫代硫酸钠溶液与稀硫酸反应的化学万式____________;
(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出
①电荷数守恒_________;
②物料守恒___________;
③质子守恒___________;
④下列粒子浓度由大到小的顺序为c(Na+)、c(HCO3-)、c(CO32-),c(H2CO3)、c(OH-)_________。
(3)常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示。所用NaOH溶液浓度为____________。
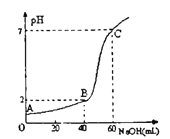
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯可以通过下列方法合成:
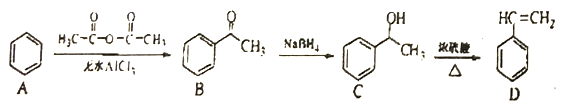
(1)A![]() B的反应的反应类型是_______;该反应还会生成另一种有机物,其结构简式为____。
B的反应的反应类型是_______;该反应还会生成另一种有机物,其结构简式为____。
(2)C中含氧官能团的名称是________;C物质能与CH3COOH在浓硫酸作用下,发生酯化反应,写出相应化学反应方程式_______
(3)检验产物D中溶有C的实验方法是______。
(4)B有多种同分异构体:E是B的芳香类同分异构体,结构上满足下列条件。则E的结构简式为_________。
A.能发生银镜反应 B.且苯环上的一氯代物只有2种
(5)对羧基聚苯乙烯(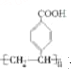 )是合成功能高分子材料的重要中间体。
)是合成功能高分子材料的重要中间体。
己知:①NaBH4为选择性还原剂,不能还原羧酸
②苯甲酸发生苯环取代时,生成间位产物.
试写出以甲苯等为主要原料,合成对羧基聚苯乙烯的流程图(无机试剂任选)合成路线流程图示例如下:![]() _____________________
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
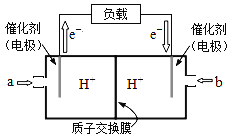
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“在2支大小相同的试管中各装入2~3mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1mol/L FeCl3溶液,对比观察现象.” Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色.
(4)Ⅱ.探讨FeCl3催化H2O2分解的机理 Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对 ![]() X与
X与 ![]() X+两种微粒,下列叙述正确的是( )
X+两种微粒,下列叙述正确的是( )
A.一定都是由质子、中子、电子组成的
B.质子数一定相同,质量数和中子数一定不相同
C.核电荷数和核外电子数一定相等
D.化学性质几乎完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2xH2O,工艺流程如下图所示。
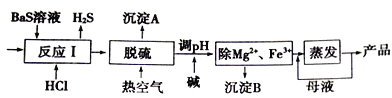
已知: 室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2。下列推断中不正确的是( )
Fe(OH)2+2Ni(OH)2。下列推断中不正确的是( )
A.充电时,Ni(OH)2为阳极
B.放电时,Fe为正极,Ni2O3为负极
C.该新型蓄电池的电解质溶液呈碱性
D.充电时,阴极反应式为Fe(OH)2+2e-=Fe+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com