
分析 (1)根据c=$\frac{1000ρω}{M}$计算公式变形计算NaOH的质量分数;
(2)氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应时,氯气有剩余,用氢氧化钠吸收后溶液中溶质为NaCl、NaClO,根据c=nV计算NaOH物质的量,根据钠离子守恒,溶液中n(NaOH)=n(NaCl)+n(NaClO),据此计算溶液中n(NaCl),溶液中n(Cl-)=n(NaCl);
(3)根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)=n(NaOH),根据电子转移守恒计算氯气与氢氧化钠反应生成NaCl,进而计算HCl与氢氧化钠反应生成的NaCl,再根据H原子守恒计算n(H2),据此解答.
解答 解:(1)根据c=$\frac{1000ρω}{M}$可知,NaOH溶液的质量分数为$\frac{3×40}{1000×1.12}$=10.7%,
答:原NaOH溶液中溶质的质量分数为10.7%;
(2)氢气与氯气反应,用NaOH吸收气体,所得的溶液中含有NaClO,故氢气与氯气反应时,氯气有剩余,用氢氧化钠吸收后溶液中溶质为NaCl、NaClO,溶液中n(NaOH)=n(NaCl)+n(NaClO)=0.1L×3mol/L=0.3mol,故溶液中n(NaCl)=0.3mol-0.05mol=0.25mol,溶液中n(Cl-)=n(NaCl)=0.25mol,
答:所得溶液中NaCl的物质的量为0.25mol;
(3)溶液中含有NaClO的物质的量为0.05mol,根据电子转移守恒,故氯气与氢氧化钠反应生成NaCl的物质的量为$\frac{0.05mol×1}{1}$=0.05mol,故HCl与NaOH反应生成的NaCl的物质的量为0.25mol-0.05mol=0.2mol,故n(HCl)=0.2mol,故n(H2)=$\frac{0.2mol}{2}$=0.1mol,氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO),故2n(Cl2)=n(NaOH)=0.3mol,所以n(Cl2)=0.15mol,故所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2,
答:所用氯气和参加反应的氢气的物质的量之比为3:2.
点评 本题考查混合物的有关计算、溶液浓度有关计算,清楚发生的反应是关键,注意利用守恒法简化计算,侧重考查学生分析计算能力,难度中等.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中铁元素可能以Fe2+形式存在 | |
| B. | 反应后溶液中c(N03-)=0.85 mol/L | |
| C. | 反应后的溶液最多还能溶解1.4 g Fe | |
| D. | 1.12 L气体可能是NO、NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、CO32-、Na+ | B. | Na+、OH-、SO42- | C. | Cu2+、OH-、H+ | D. | Ba2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②③ | C. | ①②③④ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Na+ S2- CO32- | B. | H+ Ca2+ MnO${\;}_{4}^{-}$ NO${\;}_{3}^{-}$ | ||
| C. | K+ Ca2+ Cl- HCO${\;}_{3}^{-}$ | D. | Cl- Mg2+ Al3+ OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
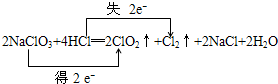
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
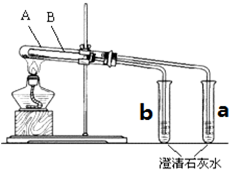 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com