【选修3-物质结构与性质】
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn
2O
4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)向一定物质的量浓度的Cu(NO
3)
2和Mn(NO
3)
2溶液中加入Na
2CO
3溶液,所得沉淀经高温灼烧,可制得CuMn
2O
4.Mn
2+基态的电子排布式可表示为______,NO
-3的空间构型为______ (用文字描述);
(2)在铜锰氧化物的催化下,CO被氧化成CO
2,HCHO被氧化成CO
2和H
2O.根据等电子原理,CO分子的结构式为______,1molCO
2中含有的σ键数目为______;
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图1),a位置上Cl原子的杂化轨道类型为______,已知其中一种化合物的化学式为KCuCl
3,另一种的化学式为______;
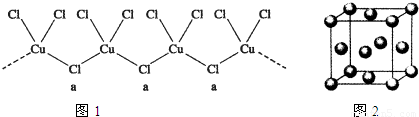
(4)用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积(如图2),边长为361pm,又知铜的密度为9.00g/cm
3,则铜晶胞的体积是______cm
3、晶胞的质量是______g,阿伏加德罗常数为______(列式计算);
(5)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是______.


 ×晶胞质量×NA,据此计算NA;
×晶胞质量×NA,据此计算NA; ×4.23×10-22g×NA,解得NA=6.01×10-23mol-1,
×4.23×10-22g×NA,解得NA=6.01×10-23mol-1,