
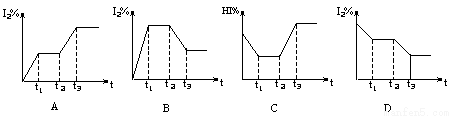
密闭容器中,充入一定量的HI气体,发生反应2HI(g) H2(g)+I2(g); ΔH>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(g)+I2(g); ΔH>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年湖北省黄石市高一上11月期中月考化学试卷(解析版) 题型:选择题
下列有关实验操作正确的是
A.蒸馏实验中温度计的水银球应插入液态混合物中
B.用酒精萃取碘水中的碘
C.分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出
D.开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西大学附属中学高一上期中化学试卷(解析版) 题型:填空题
(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3Na2CO3+H2O+CO2↑
B.2Na+Cl22NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4K2MnO4+MnO2+O2↑
E.CaO+CO2 CaCO3
CaCO3
F.4FeS2+11O22Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂的与氧化产物的物质的量比是________。
③当有9.6g铜参与反应时,在标准状况下,产生气体的体积为________L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德市高二12月月考化学卷(解析版) 题型:选择题
能鉴别碘化钾溶液、苯酚溶液、乙酸、苯和己烯五种液体的试剂为( )
A.Na2CO3溶液 B.溴水 C.新制Cu(OH)2 D.福尔马林
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷(解析版) 题型:选择题
对于相同质量的二氧化硫和三氧化硫,下列说法中正确的是( )
A.含氧原子的个数比为2:3 B.含硫原子的个数比为1:1
C.含氧元素的质量比为6:5 D.含硫元素的质量比为5:4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三化学一诊模拟理综化学试卷(解析版) 题型:选择题
某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
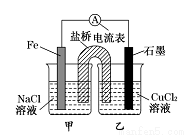
A.原电池的总反应为Fe+Cu2+ =Fe2++Cu
B.盐桥中是KNO3 溶液,则盐桥中NO3-移向乙烧杯
C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑
D.反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高二上学期期中考试化学试卷(解析版) 题型:选择题
用惰性电极电解下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是
A.CuCl2[CuO] B.NaOH[NaOH] C.NaCl[HCl] D.CuSO4[CuSO4]
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东枣庄三中高二10月学情调查化学卷(解析版) 题型:选择题
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-=Zn(OH)2 +2e-; Ag2O +H2O +2e- =2Ag +2OH-。下列说法错误的是
A.溶液中OH-向正极移动
B.锌发生氧化反应
C.氧化银是正极
D.在电池放电过程中,电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:填空题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
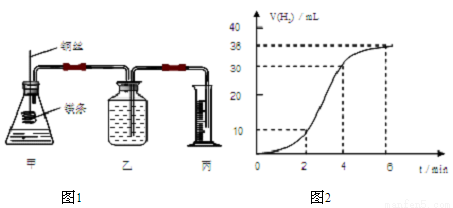
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①计算0~4min内H2的化学反应速率为______________ mL/min。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:_______。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:__________________________;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:___________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中______________________,实验b中______________________,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com