(1)用锌片、铜片和稀盐酸组成的原电池,正极的电极反应式为______,负极的电极反应式为______,原电池的总反应是______;当有6.5g锌溶解时,则在标准状况下,放出的氢气的体积为______,转移的电子数为______摩尔,溶液的酸性______(填“增强”或“减弱”).
(2)选用下列试剂和仪器设计一个原电池.画出装置图.标明原电池的正极、负极、电解质溶液,并写出正极、负极的电极反应.
试剂:铜片、铁片、银片、镁条、硫酸铜溶液、硝酸银溶液.
仪器:烧杯、导线、铁夹(若还需其它仪器可自己补充)
【答案】
分析:(1)根据原电池中正负极上得失电子写出电极反应式;根据锌与氢气、转移电子的关系计算;根据溶液中氢离子的变化判断溶液酸性的变化;
(2)根据原电池的构成条件设计原电池并写出电极反应式;
解答:解:(1)正极上氢离子得电子生成氢气,电极反应式为2H
++2e
-=H
2↑;负极上锌失电子变成离子进入溶液,电极反应式为Zn-2e
-=Zn
2+;所以电池反应式为Zn+2H
+=Zn
2++H
2↑.
Zn+2H
+=Zn
2++H
2↑ 转移电子
65g 22.4L 2mol
6.5g 2.24L 0.2mol
所以生成气体的体积为2.24L,转移电子为0.2mol
随着反应的进行,溶液中的氢离子得电子生成氢气,所以溶液中的氢离子浓度降低,溶液的酸性减弱.
故答案为:2H
++2e
-=H
2↑; Zn-2e
-=Zn
2+;Zn+2H
+=Zn
2++H
2↑;2.24L; 0.2mol;减弱.
(2)根据原电池的构成条件设计原电池,可选铜片、银片作电极,硝酸银溶液作电解质溶液.
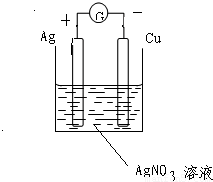
负极上铜失电子变成铜离子,电极反应式为:Cu-2e
-=Cu
2+ 正极上银离子得电子生成银,电极反应式为2Ag
++2e
-=2Ag
故答案为:
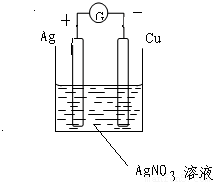
(-)Cu-2e
-=Cu
2+ (+)2Ag
++2e
-=2Ag
点评:本题考查了原电池的工作原理及设计原电池,原电池的设计要以原电池的构成条件为依据,注意电极材料及电解质溶液的选择.




