
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】昆明得天独厚的气候地理条件,造就了亚洲第一鲜花交易市场。生活中人们为了延长鲜花的寿命,通常会加入鲜花保鲜剂。
下表是0.25 L某种鲜花保鲜剂中含有的成分及含量(部分成分省略)。回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖(C12H22O11) | 12.50 | 342 |
硫酸钾(K2SO4) | 0.125 | 174 |
高锰酸钾(KMnO4) | 0.125 | 158 |
硝酸银(AgNO3) | 0.01 | 170 |
…… | …… | …… |
(1)鲜花保鲜剂的下列成分中,不属于电解质的是__________(填标号)。
a.C12H22O11 b.K2SO4 c.KMnO4 d.AgNO3
(2)欲配制250 mL该鲜花保鲜剂,现已提供下列仪器:①250mL容量瓶②量筒③烧杯④药匙⑤电子天平,如要完成实验,缺少的玻璃仪器还有_________、_________ (写仪器名称)。
(3)下列操作会使所配鲜花保鲜剂浓度偏低的是__________(填标号)。
a.容量瓶用蒸馏水洗净后没有烘干 b.用玻璃棒引流,将溶液转移到容量瓶中时有溶液洒到了容量瓶外面 c.定容时俯视刻度线 d.滴加蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线
(4)写出该鲜花保鲜剂中K+的物质的量浓度的计算式(省略成分中不含K+)_______(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫分子为正八面体构型(分子结构如图),难溶于水,在高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是( )
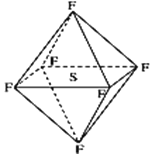
A. SF6分子是含有极性键的非极性分子
B. SF6各原子均达8电子稳定结构
C. SF6易燃烧生成SO2
D. SF6是原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R 是周期表中前 36 号元素,核电荷数依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 为非金属元素,且 X 原子的核外成对电子数是未成对电子数的 2 倍,Z 的次外层电子数是最外层电子数的![]() ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
(1)X的最高价氧化物对应的水化物分子中,中心原子采取______________杂化。
(2)化合物 XZ 与 Y 的单质分子互为______________,1mol XZ 中含有π键的数目为______________。
(3)W 的稳定离子核外有______________种运动状态的电子。W元素的第一电离能比其同周期 相邻元素的第一电离能高,其原因是:_____。
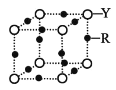
(4)Q 的晶体结构如图所示,则在单位晶胞中 Q 原子的个数为______________,晶体的配位数是______________。

(5)R元素的基态原子的核外电子排布式为________;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为 NA,则该晶体中 R 原子和 Y 原子之间的最短距离为______________cm。(只写计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+物质的量浓度最大的是( )
A. 4 L、0.5 mol·L-1NaCl溶液 B. 1 L、0.3 mol·L-1Na2SO4溶液
C. 5 L、0.4 mol·L-1NaOH溶液 D. 2 L、0.15 mol·L-1、Na3PO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为__________________;基态钙原子核外电子排布式为_________________;熔点:MgO(2852℃)高于CaO(2614℃),其原因是_____________________________。
(2)![]() 。NH4HF2中所含作用力有____________(填字母)。
。NH4HF2中所含作用力有____________(填字母)。
a. 氢键 b. 配位键 c. 共价键 d. 离子键 e. 金属键
(3)已知: ![]() .
.
①NH4+ 的空间构型为___________,与NH4+ 互为等电子体的分子或离子有_____(写两种)
②CO32- 中碳原子杂化轨道类型为______________________。
③分解产物中属于非极性分子的是_____________________(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
(4)UO2 的晶胞结构及晶胞参数如下图所示:
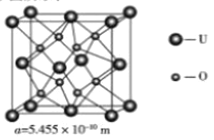
①晶胞中U的配位数为_________________。
②UO2 的密度为__________g·cm-3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(分子式为:C2H4)是来自石油的重要有机化工原料,B、D是厨房中的两种有机物,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
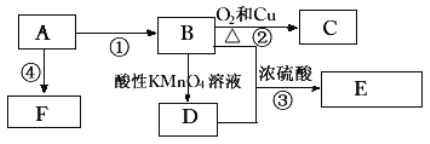
(1)A的电子式为________,官能团为:________;C的名称________,E的分子式为:________。
(2)B分子中的官能团名称是________,D分子中的官能团名称是________.
(3)写出下列反应的化学方程式并指出反应类型:
①________,反应类型________。
②________,反应类型________。
④________,反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。回答以下问题:
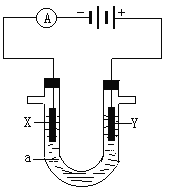
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,在 X极附近观察到的现象是:________________。
(2)Y电极上的电极反应式是_________,检验该电极反应产物的方法是:______________。
(3)如果用电解方法精炼粗铜(粗铜中含有杂质锌和银),电解液a选用CuSO4溶液,则Y 电极的材料是____,电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性 与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的价电子排布式为_______;上述材料中所含元素的基态原子中,未成对电子数最多的是_______ (填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)x]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是______(填元素符号);[Fe(CN)6] 4-中含有σ键与π键的数目比为_____________。
(3)K3AsO3可用于碘的微量分析。
①AsO33-的立体构型为_______,写出一种与其互为等电子体的分子_______(填化学式)。
②K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为_______。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为_______。

a.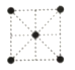 b.
b. c.
c. d.
d.
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
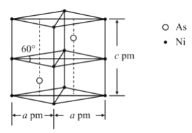
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com