
【题目】—定量CO2通入某浓度的NaOH溶液中,反应后得到溶液A,向A溶液中逐滴 滴入某浓度稀盐酸,加入V(HC1)与生成n(CO2)的关系如图所示。下列有关叙述正确的是
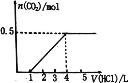
A.通入的CO2气体为11.2 L
B.A溶液中 n(NaHCO3) = 2n(Na2CO3)
C.A溶液中既含有NaOH,又含有Na2CO3
D.A溶液中可能含有NaOH和NaHCO3
【答案】C
【解析】
若溶质只有Na2CO3,加入盐酸开始发生Na2CO3+HCl=NaHCO3+NaCl,然后发生反应:NaHCO3+HCl=NaCl+CO2↑+H2O,前后两阶段消耗盐酸体积之比为1∶1,而实际消耗盐酸体积为1∶(4-1)=1∶3,故溶质为Na2CO3、NaHCO3,据此分析解答。
由图可知,开始不生成气体,后来生成气体,且耗盐酸体积为1∶(4-1)=1∶3,故溶质为Na2CO3、NaHCO3,由NaHCO3+HCl=NaCl+CO2↑+H2O可知,n(CO2)=0.5mol,Vm未知,不能计算生成二氧化碳的体积,该反应消耗盐酸为0.5mol,n(NaHCO3)=0.5mol,由Na2CO3+HCl=NaHCO3+NaCl可知,n(HCl)=n(Na2CO3)=![]() ,则原NaHCO3为0.5mol-
,则原NaHCO3为0.5mol-![]() =
=![]() ,即A溶液中n(NaHCO3)=2n(Na2CO3),故选C。
,即A溶液中n(NaHCO3)=2n(Na2CO3),故选C。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所CO2催化转化为CO的研究获得新成果。下图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法正确的是
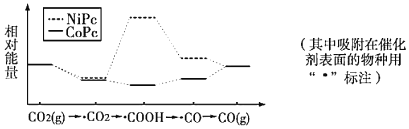
A.CO2(g)→CO(g)+l/2O2(g)过程中能量降低
B.CO2经氧化反应得到COOH
C.该条件下,催化剂NiPc比CoPc对CO2(g)→CO(g)转化效率更高
D.该研究成果将有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G,以A为原料的合成路线如下图所示。

回答下列问题:
(1)D、G分子中的官能团名称分别__________、__________。
(2)在反应①~⑥中,属于加成反应的是______,属于取代反应的是_____。(填序号)
(3)写出与G分子式相同的所有羧酸类的同分异构体:_________________
(4)写出由C与新制氢氧化铜反应的化学方程式:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
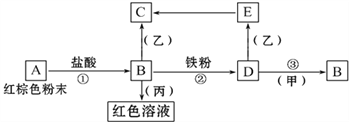
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中A12O3的含量。查阅资料得知,铝土矿的主要成分是A12O3 ,杂质是Fe2O3、SiO2等。从铝土矿中提取A12O3的过程如下:
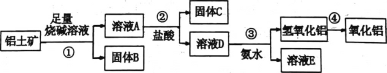
(1)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:______。
(2)第②步用到的分离方法是_______。
(3)请从下面仪器中选出第④步操作不需要的仪器_____________(填字母)
A.蒸发皿 B.玻璃棒 C.泥三角 E.酒精灯 F.坩埚
(4)将实验过程中所得固体准确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中A12O3 的质量分数__________(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为________,检验溶液中还有Fe3+的试剂是_________。
(2)—定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为3:5,则参加反应的SO2与NaOH的物质的量之比为___________。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为_________。
(4)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中 CO和CO2物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用乙醚、95%乙醇浸泡杜仲干叶,得到提取液,进步获得绿原酸粗产品的种工艺流程如下,下列说法错误的是
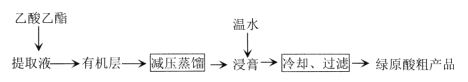
A.常温下,绿原酸易溶于水
B.浸膏的主要成分是绿原酸
C.减压蒸馏的目的是降低蒸馏温度,以免绿原酸变质
D.绿原酸粗产品可以通过重结晶进一步提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。

(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
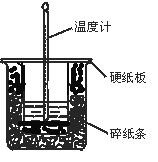
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(3)做一次完整的中和热实验,温度计需要使用______次;
(4)该实验常用0.50 mol·L-1HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容c=4.18 J/(g·℃),反应后温度升高了△t,则生成1mol水时的反应热ΔH=___________ kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、不相等”),简述理由____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com