
 .
.分析 短周期元素X、Y、Z、W核电荷数依次增大,在周期表中X是原子半径最小的元素,则X为氢元素;Y的最外层电子数是内层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故Y为氧元素;X、Z同主族,处于第ⅠA族,Z的原子序数大于氧元素,故Z为Na元素;四种元素的原子序数之和为37,故W的原子序数为37-11-8-1=17,故W为Cl元素,据此解答.
解答 解:短周期元素X、Y、Z、W核电荷数依次增大,在周期表中X是原子半径最小的元素,则X为氢元素;Y的最外层电子数是内层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故Y为氧元素;X、Z同主族,处于第ⅠA族,Z的原子序数大于氧元素,故Z为Na元素;四种元素的原子序数之和为37,故W的原子序数为37-11-8-1=17,故W为Cl元素.
(1)Cl元素原子有3个电子层,最外层电子数为7,处于第三周期第ⅦA族,故答案为:三、ⅦA;
(2)X与Y 能形成具有18个电子的化合物为H2O2,H2O2分子中氧原子之间形成1对共用电子对,氧原子与氢原子之间形成1对共用电子对,电子式为: ,故答案为:
,故答案为: ;
;
(3)X、Y、Z三种元素组成的化合物为NaOH,存在的化学键类型为离子键、共价键,故答案为:离子键、共价键;
(4)钠单质在氧气中燃烧火焰的颜色是黄色火焰;钠单质在空气燃烧生成Na2O2,含有的共价键的类型为非极性键;Y、Z、W形成的某种化合物为NaClO、NaClO3、NaClO4等,为盐类物质,属于离子化合物,
故答案为:黄色;非极性键;离子;
(5)X和Y形成的化合物为H2O等,X和W形成的化合物为HCl,水分子之间形成氢键,常温下为液态,而HCl为气态,故水的沸点高于HCl的,
故答案为:高;
(6)氯气的水溶液滴入KBr溶液中,发生反应:Cl2+2KBr=Br2+2KCl,现象是:溶液由无色变橙红色;Z、W两种元素的最高价氧化物对应水化物分别为NaOH、HClO4,二者反应的离子方程式为:H++OH-=H2O,
故答案为:溶液由无色变橙红色;H++OH-=H2O.
点评 本题考查结构位置性质关系、常用化学用语、化学键、晶体类型、元素化合物知识等,难度中等,推断元素是解题关键,注意基础知识的理解掌握.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(甲苯) | 酸性高锰酸钾溶液,NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| D | 苯(己烯) | 溴水 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性比较:S2O82 ->MnO4- | |
| B. | 氧化剂S2O82-的摩尔质量为 192 g/mol | |
| C. | 该反应中酸性介质可以为盐酸 | |
| D. | 若有0.1 mol氧化产物生成,则转移电子 0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述不正确的是( )| A. | 当电路中通过4mol电子的电量时,生成有标准状况下的O2为22.4L | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 正极区反应为2H2O-4e-═O2+4H+,正极区溶液pH降低 | |
| D. | 通电后中间隔室的SO42-离子向负极区迁移,负极区溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
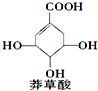 莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )| A. | 分子中含有2种官能团 | |
| B. | 在水溶液中羧基和羟基均能电离出H+ | |
| C. | 分子式为C7H6O5 | |
| D. | 可发生加成和取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com