
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液 | |
| C. | “出汗”→变成白色固体(粉末)过程中只发生物理变化 | |
| D. | 最后变成碳酸钠粉末 |
分析 钠与氧气反应生成氧化性,而变暗,氧化钠与水反应生成氢氧化钠,氢氧化钠易潮解,最后氢氧化钠和二氧化碳反应生成碳酸钠,以此解答该题.
解答 解:A.因钠很活泼,易被氧化,则金属钠在空气中易氧化形成氧化钠,出现变暗现象,故A正确;
B.氧化钠与空气中的水反应生成氢氧化钠,氢氧化钠吸收空气中的水蒸气在表面形成了溶液,可观察到“出汗”,故B正确;
C.氢氧化钠与二氧化碳反应生成碳酸钠,为化学变化,故C错误;
D.生成的氢氧化钠再与空气中的二氧化碳反应生成碳酸钠的结晶水合物,最终风化变成白色粉末为碳酸钠,故D正确.
故选C.
点评 本题考查钠在空气中的一系列变化,为高频考点,侧重元素化合物知识的综合理解和运用的考查,明确钠及其化合物的性质是解答本题的关键,注意发生的化学反应及氧化还原反应的判断,题目难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:多选题
| 反应 | 现象 | |
| A | 把明矾溶液滴入含悬浮泥沙的水中 | 产生不溶物 |
| B | 在氯气中点燃氢气 | 产生苍白色火焰 |
| C | 将氯气通入紫色石蕊溶液 | 溶液最终由紫色变为红色 |
| D | 向硅酸钠浓溶液中滴入稀硫酸 | 出现胶状物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高氯酸盐和水均为强电解质 | |
| B. | 1H2O与2H2O互为同位素 | |
| C. | 高氯酸盐结构中一定含有共价键和离子键 | |
| D. | 常温下,高氯酸盐水溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).苯(
近期微博热传的“苯宝宝表情包”是一系列苯的衍生物配以相应的文字形成的(如图所示).苯(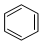 )属于( )
)属于( )| A. | 氧化物 | B. | 硫化物 | C. | 无机物 | D. | 有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入CO2得到的无色溶液 | |
| B. | 向碘的水溶液中滴加四氯化碳充分振荡后,静置后的下层液体 | |
| C. | 向沸水中滴入饱和的FeCl3溶液得到的红褐色液体 | |
| D. | 向稀硫酸中加入BaCl2溶液得到的分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量、不同密度的NO和CO | B. | 同温度、同体积的H2和O2 | ||
| C. | 同体积、同密度的C2H4和C3H6 | D. | 同压强、同体积的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ② | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com