


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、苯的分子是环状结构,其性质跟环烷烃相似 |
B、 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同 |
| C、苯的分子式是C6H6,分子中的C原子远没有饱和,因此能使溴水褪色 |
| D、苯环上的碳碳键的键能、键长介于单双键之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 1min | 2min | 5min | 15min | 20min |
| 现象 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| A、该反应是放热反应,温度升高 |
| B、反应过程中盐酸的浓度增大 |
| C、随着反应的进行,铝片表面积变小 |
| D、Cl-离子是该反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硫酸的电离方程式:H2SO3=2H++SO2-3 | ||
B、中子数为18的氯原子的原子符号:
| ||
| C、(CH3)2CHCH2CH2OH的名称:3-甲基-1-丁醇 | ||
D、HOCH2COOH缩聚产物的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢气是一种清洁能源,氢气的制取与利用是氢能源领域的研究热点
氢气是一种清洁能源,氢气的制取与利用是氢能源领域的研究热点查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.
工业上将烟气中的二氧化硫转化为硫,常用的两种方法分别是热解气还原法和离子膜电解法.查看答案和解析>>
科目:高中化学 来源: 题型:
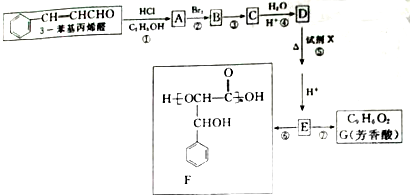
| HCl |
| C2H5OH |
| H2O |
| H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,回答问题:
如图,回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com