
【题目】恒温下,将amolN2与bmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=______________.
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量______________.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=_____________.
(4)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=______________。
【答案】(1)16;(2)8mol;(3)5:4;(4)1:2。
【解析】
试题分析:(1)反应进行到t时,测的N2为13mol,NH3为6mol,由方程式可知,参加反应的氮气的物质的量为△n(N2)=1/2△n(NH3)=6mol×1/2=3mol,故氮气的起始物质的量为:n(N2)(始)= 13mol+3mol =16mol,即a=16;(2)反应达平衡时,混合气体为n(总)=716.8L÷22.4L/mol=32mol,其中NH3的物质的量为32mol×25%=8mol;(3)利用差量法计算:
N2(g)+3H2(g)![]() 2NH3(g),物质的量减少△n
2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化:4mol 12mol 8mol 8mol
故原混合气体的物质的量为32mol+8mol=40mol,原混合气体与平衡混合气体的总物质的量之比40mol:32mol=5:4;(4)由(3)知氮气反应的物质的量是4mol,氢气反应的物质的量是12mol,n(N2)(始)=13mol+3mol=16mol,所以开始时氢气的物质的量是40mol-16mol=24mol,所以达到平衡时,N2和H2的转化率之比α(N2):α(H2)=(4mol÷16mol):(12mol÷24mol)=1:2。


科目:高中化学 来源: 题型:
【题目】I.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。已知:
2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
(1)请回答:反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.已知反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数K等于4.0 ,在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(2)该反应的平衡常数表达式为K=____________;CO的平衡转化率= _____________。
(3)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
III. 以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
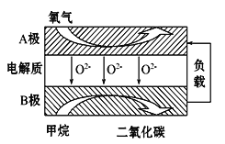
(4)B极上的电极反应式为 。
(5)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下.10mL0.40mol/LH2O2发生催化分解.不同时刻测定生成O2的休积(己折算为标准状况)如下表。
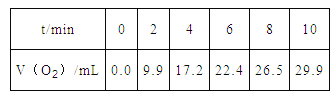
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(Lmin)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(Lmin)
C.反应至6min时,c(H2O2) = 0.30mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应多姿多彩,其中的颜色多种多样,试根据图中框图,按要求填写下列问题

(1)A的名称是______________,B的化学式是_________。
(2) 反应①的化学方程式________________________;
反应②的离子方程式_____________________________;
B和氯气的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.强电解质的饱和溶液导电能力一定强
B.凡是能导电的物质都是电解质
C.强电解质在水溶液中的电离过程是不可逆的
D.强酸溶液的酸性一定强于弱酸溶液的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一事实能说明生物界与非生物界具有统一性( )
A. 生物与非生物都具有化学变化
B. 生物与非生物都由元素构成
C. 组成生物体的化学元素在无机自然界中都可以找到
D. 生物与非生物都含有碳元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,从废水中回收金,并生产一定量的绿矾和胆矾。
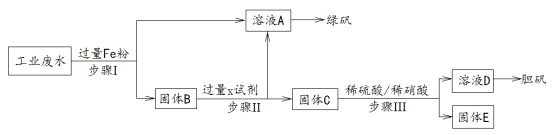
(1)试剂X是 ,固体C的成份是
(2)步骤I,II,III均需要进行的操作是
(3)写出步骤III处发生反应的离子方程式 ,稀硝酸在此反应中的作用是 , 将此过程收集到的NO与O2混合得16mL混合气体充满试管后倒扣水中,恢复原状况剩余气体为2mL,则原混合气体中NO的体积是 。
(4)制备胆矾方法有三种:①铜与混酸(稀硫酸和稀硝酸)的反应②铜与浓硫酸的反应③铜与稀硫酸和氧气的反应.请选出你认为的最佳方法,写出此方法的反应化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
A. 白色沉淀为ZnS,黑色沉淀为CuS B. 上述现象说明ZnS的Ksp小于CuS的Ksp
C. 利用该原理可实现一种沉淀转化为更难溶的沉淀 D. 该过程破坏了ZnS的溶解平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能源组合中,均属于新能源的一组是( )
①天然气;②煤;③核能;④石油;⑤太阳能;⑥生物质能;⑦风能;⑧氢能.
A. ①②③④ B. ①⑤⑥⑦⑧
C. ③④⑤⑥⑦⑧ D. ③⑤⑥⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com