
| 选项 | 操作 | 现象 | 结论 |
| A | 将足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯与溴水反应生成无色物质 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的盐酸 | 产生无色气体 | Na2O2已变质为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯中含有碳碳双键,性质较活泼,能和溴发生加成反应;
B.碳酸酸性小于盐酸,弱酸不能和强酸盐反应生成强酸;
C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
D.Na2O2、Na2CO3都能和稀盐酸反应生成无色气体.
解答 解:A.乙烯中含有碳碳双键,性质较活泼,能和溴发生加成反应生成无色物质1,2-二溴乙烷,所以溴水褪色,故A正确;
B.碳酸酸性小于盐酸,弱酸不能和强酸盐反应生成强酸,碳酸酸性小于盐酸,所以二氧化碳和氯化钙溶液不反应,则没有沉淀生成,故B错误;
C.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,发生的反应为2Fe3++Cu=Cu2++2Fe2+,该反应中氧化剂是Fe3+、氧化产物是Cu2+,所以氧化性:Fe3+>Cu2+,故C正确;
D.Na2O2、Na2CO3都能和稀盐酸反应生成无色气体,所以不能根据产生无色气体判断是否变质,故D错误;
故选AC.
点评 本题考查化学实验方案评价,为高频考点,涉及物质检验、氧化性强弱比较、酸性强弱比较等知识点,明确实验原理是解本题关键,熟练掌握元素化合物知识,易错选项是B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应A2(g)+2B2(g) 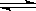 2AB2(g)△H<0,下列说法正确的是( )
2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·m
2NH3(g) ΔH=-92.4 kJ·m ol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是
ol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是
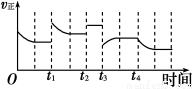
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
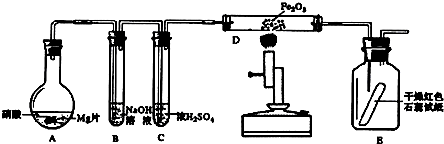
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑨ | B. | ④⑥⑦⑧ | C. | ④⑥⑦⑨ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| B. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| C. | 用饱和Na2CO3溶液鉴别乙酸、乙醇、硝基苯 | |
| D. | 利用燃烧的方法鉴别羊毛和棉花 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ⑧
⑧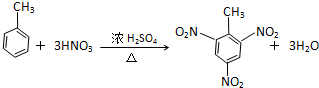 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com