
| 编号 | 仪器 | 药品 | 实验目的 |
| A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量份数的NaCl溶液 |
| B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、碳酸钠溶液 | 证明非金属性:Cl>C>Si |
| C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
| D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液,NaoH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
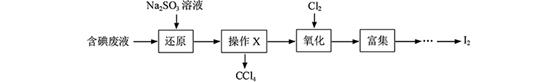
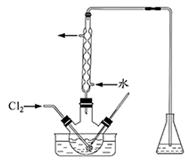
 I2+5SO42—+H2O
I2+5SO42—+H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验内容 | 实验目的或实验结论 |
| A | 向盛有2 mL 0.1 mol/L AgNO3溶液的试管中滴加5滴0.1 mol/L NaCl溶液,有白色沉淀生成,再向其中滴加5滴0.1 mol/L KI溶液 | 说明一种沉淀能转化为溶解度更小的沉淀 |
| B | 向1 mL 20% 的蔗糖溶液中加入3~5滴稀硫酸,水浴加热5 min,冷却后再加入新制Cu(OH)2悬浊液,加热 | 证明蔗糖能发生水解反应 |
| C | 水浴加热浓硝酸、浓硫酸和苯的混合物后,直接蒸馏分液后得到的粗产品 | 制备纯硝基苯 |
| D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入等体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
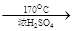 CH2=CH2↑+H2O。
CH2=CH2↑+H2O。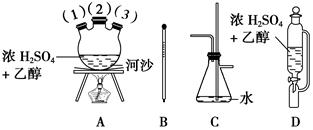
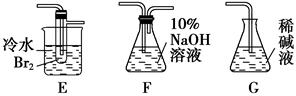
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐溶液滴入AgNO3溶液 | 有白色沉淀 | 该钠盐不一定是NaCl |
| B | 浓硫酸与NaCl固体混合加热 | 有气体产生 | 硫酸的酸性比HCl强 |
| C | 某无色气体通入溴水中 | 溴水褪色 | 该气体一定是C2H4 |
| D | 向浓度均为0.1mol·L—1的NaCl和NaI混合溶液中滴加少量的Pb(NO3)2溶液 | 出现黄色沉淀 (PbI2) | KSP(PbI2)<KSP(PbCl2) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y,分别与足量的盐酸反应 | X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com