
 .
. .
.分析 已知ABCDEF六种元素,核电荷数依次增大,A的阳离子是一个质子,则A为H元素;B的单质是空气中含量最大的成分,则B为N元素;C的核电荷数是A、B两者之和,则C的核电荷数=7+1=8,则C为O元素;F原子前两个电子层电子数之和是其电子总数的一半,F原子总电子数为20,则F为Ca元素;D原子的最外层电子数是最内层电子数的一半,其原子序数大于O(8),则D含有3个电子层,最外层含有1个电子,为Na元素;E原子得到一个电子成为8电子稳定结构,其原子序数大于Na,则E为Cl元素,据此进行解答.
解答 解:已知ABCDEF六种元素,核电荷数依次增大,A的阳离子是一个质子,则A为H元素;B的单质是空气中含量最大的成分,则B为N元素;C的核电荷数是A、B两者之和,则C的核电荷数=7+1=8,则C为O元素;F原子前两个电子层电子数之和是其电子总数的一半,F原子总电子数为20,则F为Ca元素;D原子的最外层电子数是最内层电子数的一半,其原子序数大于O(8),则D含有3个电子层,最外层含有1个电子,为Na元素;E原子得到一个电子成为8电子稳定结构,其原子序数大于Na,则E为Cl元素,
(1)BA3为NH3,氨气为三角锥形,分子结构不对称,是由极性键构成的极性分子;NH3为共价化合物,氨气分子中氮原子最外层达到8电子稳定结构,其电子式为 ,
,
故答案为:极性;三角锥形; ;
;
(2)ABE形成的化合物为氯化铵,氯化铵为在固态时为离子晶体,其中含的化学键有共价键和离子键,
故答案为:离子;共价键、离子键;
(3)F和E形成的化合物为氯化钙,氯化钙为离子化合物,用电子式表示氯化钙的形成过程为: ,
,
故答案为: ;
;
(4)C、D分别为O、Na元素,C、D可按1:1化合生成离子化合物X为过氧化钠,其化学式为:Na2O2,
故答案为:Na2O2.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意掌握常见化学用语的概念及书写原则,试题有利于提高学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
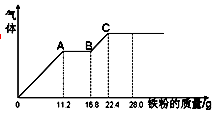 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶19.2g(己知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
| A. | Na2SO3溶液中c(H+)<c (OH-) | |
| B. | Na2SO3溶液中c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)>c(H+) | |
| C. | 当吸收液呈中性时,c(Na+))>c (SO32-)>c (HSO3-)>c (OH-)=c(H+) | |
| D. | 当吸收液呈中性时,c(Na+)>c (HSO3-)+c (SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H=a kJ•mol-1;2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,则a>b | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 在100 kPa时,1 g H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 碳酸钠水解的离子方程式:CO32-+2H2O?OH-+H2CO3 | |
| C. | CH3COOH的电离方程式为:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 次氯酸的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 用10 mL量筒量取9.2 mL NaCl溶液 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入稀盐酸和BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 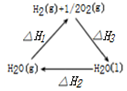 图表示:△H1=△H2+△H3 | |
| B. | 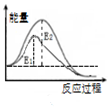 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. | 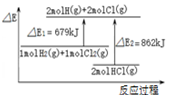 图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 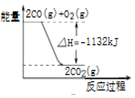 图表示:CO的燃烧热为1132KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -- | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.l | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
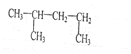
| A. | ②⑤⑥ | B. | ②④ | C. | ④⑤ | D. | ①③⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com