
| A. | FeO | B. | Fe2O3 | C. | CuO | D. | Fe3O4 |
分析 先根据生成的气体通入足量澄清石灰水中得到60g沉淀求出二氧化碳的物质的量,再计算出金属氧化物中氧元素的质量,然后利用金属氧化物的质量来计算金属元素与氧元素的质量比,则选项中金属元素与氧元素的质量比符合的即为正确答案.
解答 解:由题意知60g沉淀为碳酸钙的质量,
则碳酸钙的物质的量为$\frac{60g}{100g/mol}$=0.6mol,
由CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中得到沉淀,
设金属氧化物中氧元素的质量为x,
根据碳元素守恒可知CO~O~CO2~CaCO3,
16 1
x 0.6mol
x=$\frac{16×0.6mol}{1}$,解得x=9.6g,
则32.0g氧化物中金属元素与氧元素的质量比为$\frac{32.0g-9.6g}{9.6g}$=7:3,
A、FeO中铁与氧元素的质量比为56:16=7:2,与计算结果不符,故A错误;
B、Fe2O3中铁与氧元素的质量比为56×2:16×3=7:3,与计算结果符合,故B正确;
C、CuO中铜与氧元素的质量比为64:16=4:1,与计算结果不符,故C错误;
D、Fe3O4中铁与氧元素的质量比为56×3:16×4=21:4,与计算结果不符,故D错误;
故选B.
点评 本题考查学生利用化学反应及物质的化学式的计算,明确反应中元素的守恒来分析金属氧化物中氧元素的质量是解答的关键,并应熟悉元素的质量比计算方法来解答即可.


科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32-、SO42-、H+ | B. | K+、AlO2-、H+、Cl- | ||
| C. | Fe3+、K+、OH-、NO3- | D. | Al3+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在101kPa时,1molS完全燃烧生成SO3时所放出的热量,是S的燃烧热 | |
| B. | 吸热反应必须加热才能反应,放热反应不需要加热 | |
| C. | 在101kPa时,1mol S和2mol S的燃烧热相同 | |
| D. | 在稀溶液中,H2SO4和Ba(OH)2完全中和产生1mol水时放出的热量为57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1醋酸 | B. | 0.1 L 1 mol•L-1H2SO4溶液 | ||
| C. | 0.5 L 0.1mol•L-1盐酸 | D. | 2 L 0.1mol•L-1 H2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L -1 NaHC2O4溶液与0.1 mol•L -1KOH溶液等体积混合,所得溶液中:c(Na+)>c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-) | |
| B. | 20mL 0.1 mol•L -1NH4Cl溶液与10mL 0.1 mol•L -1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:c(Na+)+c(OH-)>c(H+)+c(F-) | |
| D. | 0.1 mol•L -1NH3•H2O溶液与0.1 mol•L -1HNO3溶液等体积混合,所得溶液中:c(H+)>c(OH-)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 标号 |
| 检验氯化亚铁是否变质 | |
| 除去食盐中少量细砂 | |
| 除去碳酸钠固体中少量碳酸氢钠 | |
| 除去镁粉中混有的少量铝粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
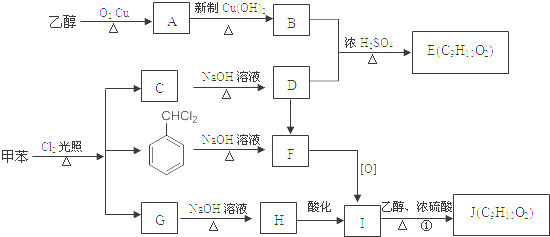

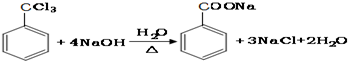 .
.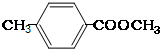 ;②
;②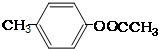 ;③
;③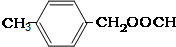 或
或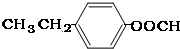 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com