
ij�¶��£���2 L�����ܱ������г���1.0 mol A��1.0 mol B����ӦA(g)��B(g)  C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ����������������˵����ȷ����
C(g)������һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ����������������˵����ȷ����
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
D
����A�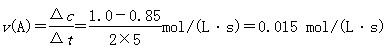
B��ɱ��������ݿ�֪ƽ��ʱc(A)��0.8/2��0.4 mol/L������AŨ������ƽ�����淴Ӧ�����ƶ�����H��0��C�������2 mol C������ƽ��������ƽ���Ч����Cת����Ϊ80%���൱��A��B����2 mol����ԭƽ����൱�ڼ�ѹ��ƽ��������Ӧ�����ƶ�����C��ת���ʽ��ͣ�D�����ƽ��ʱ��ϵ�к���0.8 mol A��0.8 mol B��0.2 mol C����ѡ����ϵ�з�Ӧ������У��淴Ӧ���ʴ�


 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ij�ܱ������г�������ʵ���������A��B��һ���¶��·�����ӦA(g)��xB(g) 2C(g)���ﵽƽ���ֻ�ı䷴Ӧ��һ����������������и����ʵ�Ũ�ȡ���Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
2C(g)���ﵽƽ���ֻ�ı䷴Ӧ��һ����������������и����ʵ�Ũ�ȡ���Ӧ������ʱ��仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����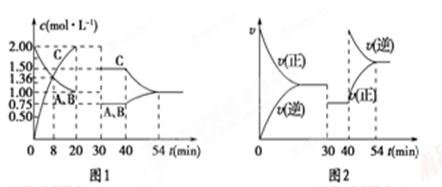
| A��30 minʱ�ı�������ǽ����¶ȣ�40 minʱ�ı�������������¶� |
| B��8 minǰA��ƽ����Ӧ����Ϊ0.08 mol/(L��min) |
| C����Ӧ�Ļ�ѧ����ʽ�е�x��1��������ӦΪ���ȷ�Ӧ |
| D��20 min��÷�Ӧ��ƽ�ⳣ����Ϊ4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��ӦA(g)��3B(g)=2C(g)��D(g)��ij��ʱ������A��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ1 mol/(L��min)����˶�ʱ������C��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ����Ϊ�� ��
| A��0.5 mol/(L��min) | B��1 mol/(L��min) |
| C��2 mol/(L��min) | D��3 mol/(L��min) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�跴Ӧ��Fe(s)��CO2(g)  FeO(s)��CO(g) ��H��a kJ/mol����Ӧ��Fe(s)��H2O(g)
FeO(s)��CO(g) ��H��a kJ/mol����Ӧ��Fe(s)��H2O(g)  FeO(s)��H2(g) ��H��b kJ/mol����������Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
FeO(s)��H2(g) ��H��b kJ/mol����������Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���б����еĸ����������������ͼ��ʾ���߱�ʾ����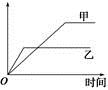
| ѡ�� | ��Ӧ | ������ | �� | �� |
| A | ��ͬ�����İ�������ͬһ�����з�����Ӧ��2NH3 N2��3H2 N2��3H2 | ������ת���� | 500 �� | 400 �� |
| B | �������ļء��Ʒֱ���������ˮ��Ӧ | H2������ | �� | �� |
| C | ������ɱ�ĺ�ѹ�����У����֮��Ϊ1��3��N2��H2��N2��3H2 2NH3 2NH3 | ������Ũ�� | ���ԸߵĴ��� | ����һ��Ĵ��� |
| D | 2 mol SO2��1 mol O2����ͬ�¶��·�����Ӧ��2SO2��O2 2SO3 2SO3 | SO3�����ʵ��� | 2������ѹ | 10������ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���̶��ݻ����ܱ������У�����һ���¶Ƚ������·�Ӧ��H2(g)��Br2(g)  2HBr(g)����֪����1 mol H2��2 mol Br2�ﵽƽ���������a mol HBr������ͬ�����£�����ʼʱ�����H2��Br2��HBr�ֱ�Ϊx mol��y mol��z mol(����Ϊ0)�ұ���ƽ��ʱ������ְٷֺ��������䡣�����ƶ���һ����ȷ����
2HBr(g)����֪����1 mol H2��2 mol Br2�ﵽƽ���������a mol HBr������ͬ�����£�����ʼʱ�����H2��Br2��HBr�ֱ�Ϊx mol��y mol��z mol(����Ϊ0)�ұ���ƽ��ʱ������ְٷֺ��������䡣�����ƶ���һ����ȷ����
��x��y��zӦ����Ĺ�ϵΪ��4x��z=2y?
�ڴﵽƽ��ʱHBr�����ʵ���Ϊ(x+y+z)/3 amol?
�۴ﵽƽ��ʱHBr�����ʵ���Ϊa mol?
��x��y��zӦ����Ĺ�ϵΪx��y=z?? ��
| A���٢� | B���ڢ� | C���ۢ� | D���٢ڢ�? |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����������Һ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ��Na2S2O3��H2SO4=Na2SO4��SO2��S����H2O�����и���ʵ�������ȳ��ֻ��ǵ���(����)
| ʵ�� | ��Ӧ�¶�/�� | Na2S2O3��Һ | ϡH2SO4 | H2O | ||
| V/mL | c/(mol��L��1) | V/mL | c/(mol��L��1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���淴ӦmA(g)��nB pC(g)��qD(����A��C������ɫ����)�����ﵽƽ��ʱ������������ȷ����(����)
pC(g)��qD(����A��C������ɫ����)�����ﵽƽ��ʱ������������ȷ����(����)
A������ѹǿ��ƽ�ⲻ�ƶ���˵��(m��n)һ������(p��q)
B�������¶ȣ�A��ת���ʼ�С��˵������Ӧ�����ȷ�Ӧ
C��������B������ƽ����ϵ��ɫ���˵��B������������
D����B�����壬����A������A��Bת���ʶ�һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij�¶��£����ڷ�ӦN2(g)��3H2(g)  2NH3(g)����H����92.4kJ/mol��N2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
2NH3(g)����H����92.4kJ/mol��N2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��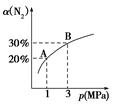
A����1 mol������3 mol����������1 L�ܱ������з�����Ӧ���ų�������Ϊ92.4 kJ
B��ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A)��K(B)
C��������Ӧ�ڴﵽƽ�������ѹǿ��H2��ת��������
D�������¶ȣ�ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ������������Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com