
Ag/A12O3催化剂在工业上具有广泛用途。废银催化剂中银的回收既可节约资源,又有较好的经济效益。回收银的简化流程如下图所示(部分条件和试剂略):

请回答下列问题:
(1)第I步中,载体A12O3不与稀硝酸反应。Ag和稀硝酸反应产生的气体是____________。
(2)第II步中,饱和食盐水由工业食盐水提纯而得。除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,正确的操作顺序是_________(填字母编号)。
a.加入稍过量的NaOH溶液
b.加入稍过量的BaC12溶液
c.过滤
d.加入稍过量的Na2CO3溶液
e.加入适量盐酸
(3)第III步中,加入氨水使沉淀溶解的离子方程式是____________ 。
(4)N2H4具有还原性,氧化产物为N2。第IV步反应的产物除Ag和N2外,还有的物质是_______(填化学式)。
(5)N2H4可用作火箭推进剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H = -534 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H = -116 kJ/mol
N2(g)+O2(g)=2NO(g) △H = +183 kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是______________________。
(6)Ag可制备银锌纽扣电池正极材料Ag2O,碱性条件下该电池的正极反应式是____。
(7)若上述流程中第I、II、III步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是________kg。
科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:填空题
用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I: 4NH3(g)+6NO(g) 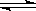 5N2(g)+6H2O(l) ΔH1
5N2(g)+6H2O(l) ΔH1
反应II: 2NO(g)+O2(g) 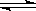 2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
2NO2(g) ΔH2(且|ΔH1|=2|ΔH2|)
反应III:4NH3(g)+6NO2(g) 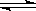 5N2(g)+3O2(g)+6H2O(l) ΔH3
5N2(g)+3O2(g)+6H2O(l) ΔH3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)ΔH3=____________(用ΔH1、ΔH2的代数式表示);推测反应III是________反应(填“吸热”或“放热”)。
(2)相同条件下,反应I在2 L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。

①计算0~4分钟在A催化剂作用下,反应速率v(NO)=______________。
②下列说法不正确的是_______。
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如右。溶液中OH?向电极____移动(填a或b),负极的电极反应式为________________。

查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:填空题
蛋白质的性质在生活中有许多实际应用.请在下表“性质”一栏中表述的蛋白质性质填空.
实例 | 性质 |
(1)紫外线消毒 | 变性 |
(2)蛋白质遇浓硝酸变黄 | |
(3)误食了重金属离子,可以立即喝大量的牛奶来缓解毒性 | |
(4)鸡蛋清溶液中加入少量饱和的硫酸铵溶液出现沉淀 | |
(5))常用酒精清洗伤口 | |
(6)蒸煮鸡蛋食用 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
下列说法中正确的是( )
A.糖类是有甜味的物质
B.糖类组成一定符合通式Cm(H2O)n
C.糖类是人类维持生命的六大类营养素之一
D.符合通式Cm(H2O)n的一定是糖
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上定时训练(七)化学试卷(解析版) 题型:选择题
20.14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为
A.9.6g B.6.4g C.3.2g D.1.6g
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,W原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A. X、Y、Z形成的化合物不止一种
B. X的氢化物比Y的氢化物稳定
C. 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
D. Y与Z或W形成的化合物中只含离子键
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月阶段测化学卷(解析版) 题型:填空题
物质结构与性质分钒、砷均属于第四周期元素,最高正价均为+5。
I.高纯度砷可用于生产具有“半导体贵族”之称的新型半导体材料 GaAs,砷与氯气反应可得到 AsCl3、AsCl5两种氯化物。
(1)两种氯化物分子中属于非极性分子的是 ,AsCl3分子的中心原子杂化类型是 ,分 子构型是 。
(2)Ga 与 As 相比,第一电离能较大的元素是 ,GaAs 中砷的化合价为 。研究表明,在 GaAs 晶体中,Ga、As 原子最外电子层均达到 8 电子稳定结构,则 GaAs 的晶体类型是 ,晶体中化学键的键角是 。
II.钒是一种重要的战略金属,其最主要的用途是生产特种钢,其化合价有+5、+4、+3、+2 等,工业上从炼钢获得的富钒炉渣中(内含 V2O5)提取钒的过程如下。


(3)基态钒原子的电子排布式为 ,上述钒的几种价态中,最稳定的是 价;写出①、②反应的化学方程式: 、 。
(4)已知单质钒的晶胞为 则 V 原子的配位数是 ,假设晶胞的边长为 d cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
则 V 原子的配位数是 ,假设晶胞的边长为 d cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列实验方案中,不能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 除去CO2气体中的SO2气体 | 将混合气体通入饱和碳酸氢钠溶液,洗气 |
B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
C | 验证Br2的氧化性强于I2 | 强少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红色 |
查看答案和解析>>
科目:高中化学 来源:2017届广西省高三上学期10月月考化学试卷(解析版) 题型:填空题
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)检验FeCl3溶液中阳离子的方法是
(2)FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)
FeCl3溶液也常用于腐蚀印刷电路板,反应的离子方程式为
(3)通过控制条件,将FeCl3水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O 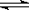 Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是 (填序号)。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是 (填序号)。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(4)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3。完成NaClO3 氧化FeCl2 的离子方程式 。
(5)处理废水时,发现FeCl3并不能使酸性废水中的悬浮物沉降除去,其原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com