
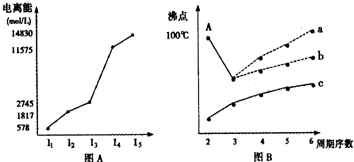
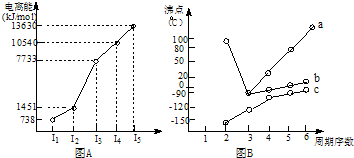
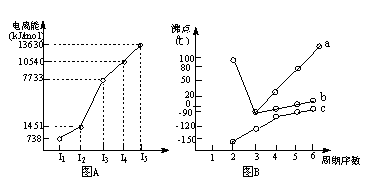
(18分)(1)I.短周期某主族元素M的电离能情况如右图(A)所示。则M元素位于周期表的第 族。
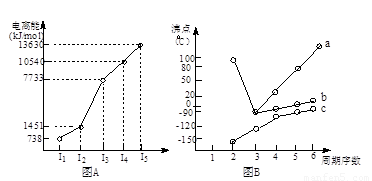
II.图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”)
III.部分有机物的熔沸点见下表:
|
烃 |
CH4 |
CH3CH3 |
CH3(CH2)2CH3 |
硝基苯酚 |
|
|
|
|
沸点/℃ |
-164 |
-88.6 |
-0.5 |
熔点/℃ |
45 |
96 |
114 |
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
,
。
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有
________(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键。
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
(1)Ⅰ.ⅡA Ⅱ. ⅣA b 有机物分子量越大,分子间作用力越强,故沸点越高;当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高。(第一条必须写到,正确给2分;后两条任意写到1条均可,两条共4分)
(2)sp2 c (3)Ⅰ. 3d24s2 Ⅱ.[TiCl(H2O)5]Cl2•H2O 每空2分
【解析】(1)Ⅰ.共计图像可知,A的第三电离能远大于第二电离能,所以A是第ⅡA元素。
Ⅱ.共计图像可知,折线c不是的氢化物的沸点逐渐升高,但都小于0℃。由于氨气、水、HF分子中都含有氢键,在该主族元素中沸点最高,所以c表示的是第ⅣA元素,其中b曲线是正确的,a曲线是错误的。
Ⅲ。根据三种烷烃的沸点可知,有机物分子量越大,分子间作用力越强,故沸点越高;由于邻硝基苯酚能形成分子内氢键,而对硝基苯酚内形成分子间氢键,所以根据硝基苯酚的熔点变化可知,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高。
(2)光气是平面型结构,所以碳原子是sp2杂化。其中碳和氧形成的是碳氧双键,所以选项c正确。
(3)Ⅰ。根据构造原理可知,Ti元素的基态原子的价电子层排布式为3d24s2。
Ⅱ。由于作为配体的氯离子不能和硝酸银分液生成氯化银沉淀,所以根据所的沉淀的质量关系可知,绿色晶体配合物只有1个氯离子是配体,所以化学式为[TiCl(H2O)5]Cl2•H2O。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 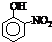 |
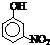 |
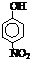 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山一中高二下学期期末考试化学试卷(带解析) 题型:问答题
(18分)(1)I.短周期某主族元素M的电离能情况如右图(A)所示。则M元素位于周期表的第 族。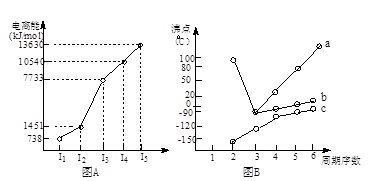
II.图B折线c可以表达出第 族元素氢化物的沸点的变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”)
III.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 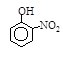 | 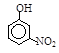 | 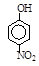 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)I.短周期某主族
 元素M的电离能情况如右
元素M的电离能情况如右
图(A)所示。则M元素
位于周期表的第 族。
II.图B折线c可以
表达出第 族元素氢
化物的沸点的变化规律。两
位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:__________(填“a”或“b”)
III.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |
|
|
|
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
,
。
(2)COCl2俗称光气,分子中C原子采取 杂化成键;其中碳氧原子之间共价键含有 ________(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键。
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为 ;
II.已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的2/3。则绿色晶体配合物的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com