
(12分)已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
|
① |
HF |
Ka=6.8×10-4 mol•L-1 |
|
② |
CH3COOH |
Ka=1.7×10-5 mol•L-1 |
|
③ |
HCN |
Ka=6.2×10-10 mol•L-1 |
|
④ |
H2CO3 |
Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 |
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是_____________,四种酸中酸性最弱的是_____________。
(2)写出H2CO3电离方程式是 、 。
(3)写出反应的方程式:足量的氢氟酸与碳酸钠溶液混合:___________ ______,
足量的CO2通入NaCN溶液中:_________ _____。
(1)氢氟酸, HCN
(2)H2CO3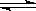 HCO3—+H+,
HCO3—
HCO3—+H+,
HCO3—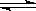 CO32—+H+
CO32—+H+
( 3)2HF+Na2CO3=2NaF+H2O+CO2↑, NaCN+H2O+CO2= HCN+NaHCO3
【解析】(1)电离常数越大,相应酸的酸性越强,所以根据电离常数可知,酸性最强的是氢氟酸,而最弱的是HCN。
(2)碳酸是二元弱酸,电离是分步进行的,所以电离方程式依次是
H2CO3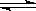 HCO3—+H+、HCO3—
HCO3—+H+、HCO3—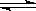 CO32—+H+。
CO32—+H+。
(3)由于氢氟酸的电离常数大于碳酸的电离常数,所以根据较强酸制取较弱的酸可知,反应的方程式是2HF+Na2CO3=2NaF+H2O+CO2↑;由于碳酸的第一步电离常数大于HCN的,但第二步小于HCN的,所以足量的CO2通入NaCN溶液中反应方程式是NaCN+H2O+CO2= HCN+NaHCO3。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:阅读理解
(15分)(1)、美国化学家富兰克林提出了酸碱的溶剂理论,对酸碱定义如下:在某溶剂的溶液中,凡能解离产生该溶剂阳离子的物质为酸;凡能解离产生该溶剂阴离子的物质为碱。这一理论不仅概括了水溶液中的酸碱概念,而且把酸碱概念引入非水溶剂,例如在液氨中2 NH3![]() NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
NH4++NH2-铵盐(如 NH4Cl )表现为酸,氨基化物(如NaNH2)表现为碱。常见的无机非水溶剂有液态氨、硫酸、液态氟化氢、液态二氧化硫、三氟化溴等。已知液体SO2和纯水的导电性相近,实验测得两者的比导电值分别为 8×10-8Ω-1?cm-1和8×10-8Ω-1?cm-1。试用简要的文字和化学反应方程式给出解释:为什么在SO2的液体中,可用Cs2SO3去滴定SOCl2?
(2)①已知盐酸是强酸,氢氟酸是弱酸。在室温下0.20mol/L氢氟酸水溶液中,氟离子的浓度是0.011mol/L,则氢氟酸的电离常数为 ; 取1.0L 0.20mol/L氢氟酸水溶液与1.0L 0.20mol/L盐酸混合,则溶液中氢离子、氟离子和氢氟酸的浓度各为 、 、 。
②某温度下,K(CH3COOH)=1.0×10-5,若醋酸的起始浓度为0.l0mol/L ,则平衡时溶液的pH是多少?(写出计算过程)
(3)①已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10,向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,c (Br-)/c (Cl-) = 。②常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,往CaSO4悬浊液中通入CO2可得到CaCO3,请解析CaSO4向CaCO3转化的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是:( )
A.常温下将pH=2的醋酸和pH=12的NaOH溶液等体积混合,所得溶液显碱性
B.已知同温时氢氟酸的电离常数大于亚硝酸的电离常数,则相同温度相同浓度的NaF溶液和NaNO2溶液的碱性:NaF溶液较强
C.将等体积的盐酸和氨水混合,充分反应后所得溶液呈中性,则两溶液的物质的量浓度关系为:c(HCl)<c(NH3·H2O)
D.常温下,pH均为5的醋酸和硫酸铝溶液,由水电离出的氢离子浓度均为1×10-9 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com