
【题目】将![]() gNa和
gNa和![]() gAl同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为
gAl同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为![]() 下列说法正确的是
下列说法正确的是![]()
A.反应中放出的气体在标准状况下的体积为![]()
B.参加反应的水的质量与加入Al的质量相等
C.所得溶液中![]() 和
和![]() 的物质的量之比为2:1
的物质的量之比为2:1
D.所得溶液中阳离子和阴离子的物质的量之比为1:1
【答案】D
【解析】
4.6g钠的物质的量为![]() =0.2mol,2.7gAl的物质的量为
=0.2mol,2.7gAl的物质的量为![]() =0.1mol;由2 Na+2H2O═2 NaOH+H2↑可知0.2molNa与水完全反应消耗0.2mol,同时生成0.2molNaOH和0.1molH2;生成的0.2molNaOH和0.1molAl继续发生反应2 Al+2 NaOH+2H2O═2 NaAlO2 +3 H2↑,其中NaOH过量,剩余0.1mol,同时参加反应的水为0.1mol,生成0.1molNaAlO2 和0.15molH2;
=0.1mol;由2 Na+2H2O═2 NaOH+H2↑可知0.2molNa与水完全反应消耗0.2mol,同时生成0.2molNaOH和0.1molH2;生成的0.2molNaOH和0.1molAl继续发生反应2 Al+2 NaOH+2H2O═2 NaAlO2 +3 H2↑,其中NaOH过量,剩余0.1mol,同时参加反应的水为0.1mol,生成0.1molNaAlO2 和0.15molH2;
A.因钠与水反应和铝与碱反应都放出气体,气体在标准状况下的体积为22.4L/mol×0.25mol=5.6L,故A错误;
B.因反应共消耗水0.3mol,质量为5.4g,Al的物质的量为0.1mol,质量为2.7g,故B错误;
C.因反应后溶液中含有0.1molNaAlO2、0.1molNaOH,没有Al3+,故C错误;
D.因反应后溶液中含有0.1molNaAlO2、0.1molNaOH,阳离子和阴离子都为1价离子,阳离子和阴离子的物质的量之比为1:1,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】快离子导体是一类具有优良离子导电能力的固体电解质。图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。回答下列问题:

(1)BF3+NH3=NH3·BF3的反应过程中,形成配位键时提供电子的原子是__,其提供的电子所在的轨道是__。
(2)基态Li+、B+分别失去一个电子时,需吸收更多能量的是__,理由是__。
(3)图1所示的晶体中,锂原子处于立方体的位置__。若其晶胞参数为apm,则晶胞密度为___g·cm-3(列出计算式即可)。
(4)氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中,则每一个空隙由__个Cl-构成,空隙的空间形状为___。
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的![]() ,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
,且氯化钠晶胞参数a=564pm。温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x,如图3)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Cl-)=185pm,![]() =1.4,
=1.4,![]() =1.7。
=1.7。
①x=__,y=__;(保留一位小数)
②迁移可能性更大的途径是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氮及其化合物的类别与化合价对应的关系图。
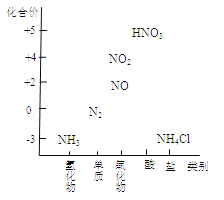
(1)实验室制取氨气。
① 化学方程式是_______。
② 可用向下排空气法收集氨气的原因是_______。
③ 用水吸收多余的氨气时,如将导管直接插入水中,
会产生倒吸现象,产生该现象的原因是_______。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:
a. 汽车尾气中产生的NO:N2 + O2 ![]() 2NO。
2NO。
b. 氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见下图。
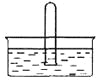
① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
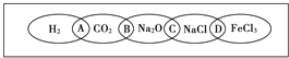
(1)请将分类依据代号填入相应的括号内:
(________)两种物质都不是电解质
(________)两种物质都是钠的化合物
(________)两种物质都是氧化物
(________)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光电池在光照条件下可产生电压,如下装置可以实现光能源的充分利用,双极性膜可将水解离为H+和OH-,并实现其定向通过。下列说法不正确的是

A.该装置中的能量转化形式:光能→电能→化学能
B.双极性膜可控制其两侧溶液分别为酸性和碱性
C.光照过程中阳极区溶液中的n(OH-)基本不变
D.再生池中的反应:2V2+ +2H2O![]() 2V3+ +2OH-+ H2↑
2V3+ +2OH-+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1mol/L的H2SO4溶液,烧杯B中盛放0.1mol/L的的CuCl2溶液(两种溶液均足量),组成的装置如图所示。下列说法不正确的是

A.A为原电池,B为电解池
B.当A烧杯中产生0.1mol气体时,B烧杯中产生气体的物质的量也为0.1mol
C.经过一段时间,B烧杯中溶液的浓度减小
D.将B中右侧石墨改为铜电极,电极上发生的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A. 20 mL 2 mol/L FeCl3溶液 B. 40 mL 1 mol/L NaHCO3溶液
C. 20 mL 1 mol/L Na2SO3溶液 D. 40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功地在铁掺杂W18O49纳米催化剂表面常温下获得较高的氨产量,反应历程如图所示(★表示被吸附在催化剂表面的物种)。下列说法错误的是
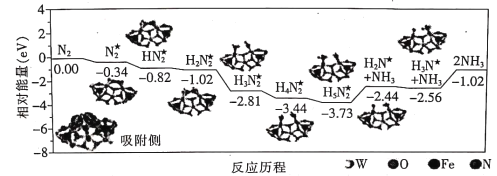
A.需要吸收能量的最大能垒(活化能)E=1.54eV
B.吸收能垒为1.29 eV步骤的反应为H5N2★=NH3+H2N★
C.选择镍掺杂W18O49纳米催化剂获得反应历程与上述不同
D.投料比[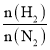 ]越大,单位时间内合成氨的产量越高
]越大,单位时间内合成氨的产量越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com