
| A. | 臭氧的摩尔质量是48 g | |
| B. | 1mol臭氧的体积是22.4L | |
| C. | 16 g臭氧中含有6.02×1023个氧原子 | |
| D. | 已知每个氧原子内有8个质子,那么1 mol臭氧中含有3mol质子 |
分析 A.摩尔质量单位是g/mol,在数值上等于其相对分子质量;
B.温度和压强未知导致气体摩尔体积未知;
C.氧原子摩尔质量是16g/mol,根据N(O)=$\frac{m({O}_{3})}{M(O)}{N}_{A}$计算氧原子个数;
D.每个氧原子中含有8个质子,则每个臭氧分子中含有24个质子.
解答 解:A.摩尔质量单位是g/mol,在数值上等于其相对分子质量,臭氧的摩尔质量是48g/mol,故A错误;
B.温度和压强未知导致气体摩尔体积未知,所以无法计算臭氧体积,故B错误;
C.氧原子摩尔质量是16g/mol,N(O)=$\frac{m({O}_{3})}{M(O)}{N}_{A}$=$\frac{16g}{16g/mol}×{N}_{A}/mol$=6.02×1023,故C正确;
D.每个氧原子中含有8个质子,则每个臭氧分子中含有24个质子,所以1 mol臭氧中含有24mol质子,故D错误;
故选C.
点评 本题考查物质的量有关计算、基本概念等知识点,为高频考点,易错选项是CD,注意臭氧是双原子分子,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 上层溶液显橙红色 | 原溶液中有Br- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈紫色 | 原溶液中有K+ |
| D | 滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 定容时仰视刻度线 | B. | 转移溶液后未洗涤烧杯和玻璃棒 | ||
| C. | 定容时俯视刻度线 | D. | 移液前容量瓶中有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
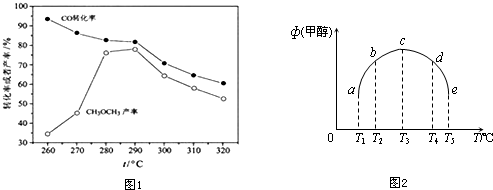
 ,32g甲在足量浓硝酸中反应转移的电子数为2NA.
,32g甲在足量浓硝酸中反应转移的电子数为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 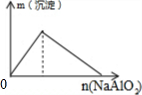 向盐酸中滴入NaAlO2溶液 | B. | 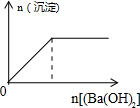 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 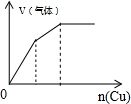 将铜粉加入到一定浓硝酸中 | D. | 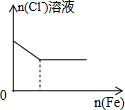 将铁粉加入到一定量氯化铁溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中铁元素的化合价降低 | B. | 该反应属于分解反应 | ||
| C. | 该反应不属于置换反应 | D. | 该反应属于化合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com